Synthesis of an Ant Alarm Pheromone
 Alarm pheromones are defensive substances which repel enemies. They are usually very volatile and produce conspicuous odours. They bring immediate attention to a harmful situation. Most of them are simple molecules; many are terpenes. They are produced by various glands and are less specific than most pheromones. Alerting pheromones should be quickly perceived and disperse quickly to be effective.
Alarm pheromones are defensive substances which repel enemies. They are usually very volatile and produce conspicuous odours. They bring immediate attention to a harmful situation. Most of them are simple molecules; many are terpenes. They are produced by various glands and are less specific than most pheromones. Alerting pheromones should be quickly perceived and disperse quickly to be effective.
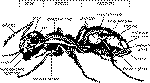
This synthesis describes a two-step route to product (3) from 1-chloro-2-methylpropane and butanal using standard experimental procedures. The target molecule, product (3), is an alarm pheromone of two ant species, Tapinoma nigerimum and Tapinoma simrothi. Both ant species are common in the Mediteranean area. The alarm pheromones are secreted by anal glands located at the tip of the ant's abdomen (see figure).
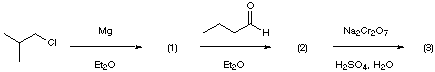
Synthesis of Intermediate (1)
 Intermediate (1) is prepared by dropwise addition of a solution of
1-chloro-2-methylpropane (4.81 g, 52 mmol) in diethyl ether (30 mL) to 1.9 g of magnesium (78 mmol) activated by a few crystals of iodine, under careful exclusion of water. After completion of the addition (approximately 20 min), the reaction mixture is refluxed for another 20 min.
Intermediate (1) is prepared by dropwise addition of a solution of
1-chloro-2-methylpropane (4.81 g, 52 mmol) in diethyl ether (30 mL) to 1.9 g of magnesium (78 mmol) activated by a few crystals of iodine, under careful exclusion of water. After completion of the addition (approximately 20 min), the reaction mixture is refluxed for another 20 min.
Synthesis of Intermediate (2)
 To the etheral solution of intermediate (1) cooled down to room
temperature, a solution of butanal (2.40 g, 33.3 mmol) in anhydrous ether (10 mL) is added dropwise with stirring. At the end of the addition, the mixture is refluxed 20 min before 5 mL of water are added dropwise followed by sufficient 5% aqueous HCl to dissolve all the inorganic salts. Excess magnesium can be removed from the mixture by gravity filtration. The organic layer is separated, washed with 30 mL of 5% aqueous NaOH and dried over Na2SO4. Removal of the ether on a rotary evaporator followed by fractional distillation of the oily residue under reduced pressure affords 3.53 g of intermediate (2) as a colorless liquid, bp 61-62 ° C/10 mm (27.1 mmol, 81% yield).
To the etheral solution of intermediate (1) cooled down to room
temperature, a solution of butanal (2.40 g, 33.3 mmol) in anhydrous ether (10 mL) is added dropwise with stirring. At the end of the addition, the mixture is refluxed 20 min before 5 mL of water are added dropwise followed by sufficient 5% aqueous HCl to dissolve all the inorganic salts. Excess magnesium can be removed from the mixture by gravity filtration. The organic layer is separated, washed with 30 mL of 5% aqueous NaOH and dried over Na2SO4. Removal of the ether on a rotary evaporator followed by fractional distillation of the oily residue under reduced pressure affords 3.53 g of intermediate (2) as a colorless liquid, bp 61-62 ° C/10 mm (27.1 mmol, 81% yield).
Synthesis of Product (3)
 In a 100-mL round-bottomed flask, 2 mL of concentrated sulfuric acid (36 mmol) and 3.2 g of sodium dichromate dihydrate (10 mmol) are dissolved in 20 mL of water. A 2.0 g portion of intermediate (2) (15 mmol) is slowly added to the acidic solution and the reaction mixture is stirred at room temperature. Its color gradually changes to green. After 1.5 h, 30 mL of diethyl ether are added. The organic phase is separated, washed with four 20-mL portions of 5% aqueous NaOH, and dried over Na2SO4. Removal of the ether on a rotary evaporator followed by fractional distillation of the residue under reduced pressure affords 1.68 g of product (3) as a colorless liquid, bp 40 ° C/10 mm (13.1 mmol, 86% yield).
In a 100-mL round-bottomed flask, 2 mL of concentrated sulfuric acid (36 mmol) and 3.2 g of sodium dichromate dihydrate (10 mmol) are dissolved in 20 mL of water. A 2.0 g portion of intermediate (2) (15 mmol) is slowly added to the acidic solution and the reaction mixture is stirred at room temperature. Its color gradually changes to green. After 1.5 h, 30 mL of diethyl ether are added. The organic phase is separated, washed with four 20-mL portions of 5% aqueous NaOH, and dried over Na2SO4. Removal of the ether on a rotary evaporator followed by fractional distillation of the residue under reduced pressure affords 1.68 g of product (3) as a colorless liquid, bp 40 ° C/10 mm (13.1 mmol, 86% yield).
[adapted from E. A. de Jong, B. L. Feringa, J. Chem. Educ., 1991,
68, 71-72]
Nom : .............................
Prénom : ...........................
Sart-Tilman, le 21 novembre 1997
1ère licence en sciences chimiques 1997-1998
Chimie organique
Interrogation de travaux pratiques
Sur base du schéma réactionnel et du mode opératoire
ci-joints, répondez de façon brève, claire et
précise aux questions suivantes.
Vos réponses doivent se trouver uniquement dans les espaces
prévus à cet effet, sur les faces recto des feuilles. Les faces
verso peuvent être utilisées comme brouillons.
1) Décrivez la façon dont vous procéderiez pour exclure toute trace d'humidité de la verrerie, des solvants et des
réactifs servant à la préparation de l'intermédiaire (1). (5 points)

2) Proposez un mécanisme pour la transformation de
l'intermédiaire (1) en (2). Indiquez clairement sur votre schéma la structure des intermédiaires (1) et (2). (2 points)

3) Écrivez l'équation moléculaire équilibrée de la réaction de transformation de l'intermédiaire (2) en produit (3). Indiquez clairement sur votre schéma la structure du produit (3). (2 points)

4) La formation du produit (3) s'accompagne d'un changement de
coloration du milieu réactionnel. Interprétez ce changement. (3 points)

5) Parmi les trois sels de calcium suivants: CaCl2, CaH2 et CaSO4, lequel utiliseriez-vous pour sécher les solutions éthérées d'intermédiaire (2) et de produit (3) si vous ne disposiez pas de Na2SO4? Justifiez votre réponse. (4 points)

6) A quelle température régleriez-vous le bain d'eau de
l'évaporateur rotatif servant à éliminer l'éther? Cette valeur est-elle critique? Justifiez votre réponse. (3 points)

7) Quelle source de vide utiliseriez-vous pour effectuer la distillation
fractionnée de l'intermédiaire (2) et du produit (3)? (1 point)

Retour au sommaire des interrogations Retour au sommaire de /licence/
 Alarm pheromones are defensive substances which repel enemies. They are usually very volatile and produce conspicuous odours. They bring immediate attention to a harmful situation. Most of them are simple molecules; many are terpenes. They are produced by various glands and are less specific than most pheromones. Alerting pheromones should be quickly perceived and disperse quickly to be effective.
Alarm pheromones are defensive substances which repel enemies. They are usually very volatile and produce conspicuous odours. They bring immediate attention to a harmful situation. Most of them are simple molecules; many are terpenes. They are produced by various glands and are less specific than most pheromones. Alerting pheromones should be quickly perceived and disperse quickly to be effective.
