Sart-Tilman, le 10 novembre 1999
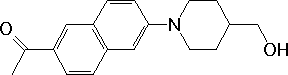
Le chauffage à 80°C dans le N,N-diméthylformamide du composé (1) ci-dessous mélangé avec le cétal de spipérone fournit un composé secondaire (2) de formule moléculaire C18H21NO2 qui n'incorpore pas la spipérone.

(1)
Expliquez vos attributions des signaux du spectre RMN des protons de (1) dont les caractéristiques sont indiquées ci-dessous. En cas d'incertitude, proposez une (des) expérience(s) permettant de la lever.
A partir de son spectre RMN des protons, déterminez la structure de (2) qui comporte aussi une fonction alcool primaire
|
Spectre RMN des protons de (1) |
Spectre RMN des protons de (2) |
|
8,32 (d, 1H) |
8,30 (d, 1H) |
|
7,94 (dd, 1H) |
7,91(dd, 1H) |
|
7,80 (d, 1H) |
7,78 (d, 1H) |
|
7,66 (d, 1H) |
7,59 (d, 1H) |
|
7,32 (dd, 1H) |
6,99 (dd, 1H) |
|
7,10 (d, 1H) |
6,71 (d, 1H) |
|
3,94 (d élargi, 2H) |
3,79 (t, 2H) |
|
3,58 (d, 2H) |
3,64 (dd, 1H) |
|
2,89 (ddd, 2H) |
3,53 (ddd, 1H) |
|
2,68 (s, 3H) |
3,43 (ddd, 1H) |
|
1,91 (d élargi, 2H) |
3,10 (dd, 1H) |
|
1,76 (m, 1H) |
2,66 (s, 3H) |
|
1,44 (m, 2H) |
2,50 (m, 1H) |
|
2,27 (m, 1H) |
|
|
1,79 (m, 2H) |
|
|
1,75 (m, 1H) |
Réponse à la question de spectroscopie
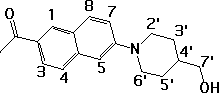
(1)
Spectre RMN des protons de (1)
1: 8,32 (d, 1H); 3: 7,94 (dd, 1H); 8: 7,80 (d, 1H);4: 7,66 (d, 1H);7: 7,32 (dd, 1H);
5: 7,10 (d, 1H); 6',2':3,94 (d élargi, 2H); 7': 3,58 (d, 2H); 6',2': 2,89 (ddd, 2H);
CH3CO: 2,68 (s, 3H); 5',3': 1,91 (d élargi, 2H); 4': 1,76(m, 1H); 5',3': 1,44(m, 2H).
Explications:
Partie aromatique:
de 7,1 à 8,32 ppm: 6 protons aromatiques (2 points); 3 et 7 sont les doublets de doublets dus aux couplages en ortho et méta (3 points) (il n'y a donc pas de couplage entre protons de cycles aromatiques différents car cela conduirait à des schémas plus complexes). Pour distinguer entre le cycle de droite et celui de gauche on pourrait se baser sur des tables appropriées ou expérimentalement recourir à des mesures d'effets nucléaires overhauser sur les protons 3,1 ou 5,7 (irradiation du CH3 ou des protons 2', 6'). Le spectre 2D corrélant les protons seul ne peut donner cette information; pour cela, il faut connaître les attributions C-13 (par corrélation entre C-13) et ensuite déterminer les corrélations protons - carbones-13. (1 point).
Attribution à 2,68 (1 point)
Doublet à 3,52 valant pour deux protons équivalents par rotation interne (1 point) couplés au proton 4' (1 point).
N.B. J'ai admis l'inversion avec 3,94 mais si l'élargissement était du au couplage résiduel avec le OH, on verrait ce groupement ce qui n'est pas le cas. Un élargissement peut être du à un couplage non résolu.
Hétérocycle:
Les 4 protons en a de N doivent être déblindés (1 point), les protons axiaux et équatoriaux sur un même carbone sont anisochrones (pas d'inversion rapide du cycle) (2 points) mais la rotation rapide autour de la liaison N-C(6) rend les protons axiaux et équatoriaux isochrones deux à deux par équivalence dynamique (2 points) (pas par symétrie !!!). Les schémas de couplage sont donc assez complexes puisqu'il y a un couplage géminé et deux couplages vicinaux et que l'approximation de premier ordre n'est pas nécessairement vérifiée.
Le pic à 1,76 est évidemment en 4' (1 point).
Produit 2:
Conservation de la partie aromatique et du CH3CO (2 points)
A 3,79 le triplet valant pour deux protons équivalents est caractéristique d'un CH2 voisin d'un O et couplé à un autre CH2. On a donc la chaîne CH2CH2OH (2 points), ce qui d'après la formule moléculaire conduit à un hétérocycle à cinq pièces (1 point).
Référence:
Magn. Reson. Chem., 36, 873, 1998
Retour au sommaire des interrogations Retour au sommaire de /licence/