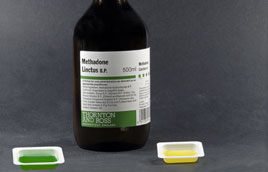
 | Synthesis of methadone, an opioid analgesic used in narcotic addiction treatment |
Methadone is a synthetic opioid analgesic first synthesized in 1937 by Max Bockmühl and Gustav Ehrhart who were working for the Hoechst Laboratories of IG Farben.1 The two German scientists were searching for an analgesic that would be easy to use during surgery and also have low addiction potential.
When used by heroin or morphine addicts, methadone fills the m-opioid receptors in the brain, essentially taking the place of those opiates and negating their influence. Methadone is longer lasting than heroin, allowing 24 to 36 hours before it must be retaken rather than 6 hours between heroin fixes. It can be taken orally, breaking an addict's pattern of injection, and it produces a weak "high" that disappears with longer treatment, as does the intense craving for more. Several of these properties were noticed in the late 1940s, and methadone began being used to help detoxify heroin and morphine addicts who were trying to kick the habit. Withdrawal from methadone is tough but less painful than withdrawal from other opiates.2
 In Belgium, methadone has been available with a prescription in pharmacies since the 1970s but physicians who began to prescribe it to addicts at the beginning of the 1980s, when the heroin epidemic was worsening, were often subjected to disciplinary sanctions by the Belgian Medical Association and sentenced by courts of justice. At the beginning of the 1990s a group of physicians requested that the Supreme Court revoke the Medical Association's regulations permitting the indictmemt of physicians prescribing methadone and other substitution treatments. This request was granted. Subsequently, the regional authorities of the French speaking part of Belgium began to encourage physicians to treat opiate addicts with methadone. The authorities became aware of drug addiction's impact on criminality and on the AIDS epidemic. They knew that it would be impossible to extend rapidly the number of methadone clinics and they also wanted to avoid stigmatizing heroin addicts. To encourage the treatment of addicts in normal settings, they allocated funds for training sessions of general practicioners on treatment of drug addiction.3
In Belgium, methadone has been available with a prescription in pharmacies since the 1970s but physicians who began to prescribe it to addicts at the beginning of the 1980s, when the heroin epidemic was worsening, were often subjected to disciplinary sanctions by the Belgian Medical Association and sentenced by courts of justice. At the beginning of the 1990s a group of physicians requested that the Supreme Court revoke the Medical Association's regulations permitting the indictmemt of physicians prescribing methadone and other substitution treatments. This request was granted. Subsequently, the regional authorities of the French speaking part of Belgium began to encourage physicians to treat opiate addicts with methadone. The authorities became aware of drug addiction's impact on criminality and on the AIDS epidemic. They knew that it would be impossible to extend rapidly the number of methadone clinics and they also wanted to avoid stigmatizing heroin addicts. To encourage the treatment of addicts in normal settings, they allocated funds for training sessions of general practicioners on treatment of drug addiction.3
In recent years, methadone has also gained popularity among physicians for the treatment of chronic pain. This increased usage came as doctors searched for an opioid drug that could be dosed less frequently than short-acting drugs such as morphine or hydrocodone. Methadone, with its long half-life, oral bioavailability, and long duration of effect is a common second-choice drug for pain that does not respond to weaker agonists.4
1. Synthesis of 1-(dimethylamino)-2-chloropropane5
A solution of 1-(dimethylamino)-2-propanol (37.7 g, 0.37 mol) in 100 ml of chloroform was cooled with stirring to 0 °C. A solution of freshly distilled thionyl chloride (57.2 g, 0.48 mol) in 20 ml of chloroform was added thereto. The reaction mixture was brought back to room temperature over 30 min and then boiled under reflux for another 30 min (caution: work in an efficient fume hood). 1-(Dimethylamino)-2-chloropropane hydrochloride began to precipitate from the boiling solution. The reaction mixture was cooled, diluted with diethyl ether and filtered. The precipitate weighed 55 g (95% yield). Recrystallization from isopropanol afforded pure 1-(dimethylamino)-2-chloropropane hydrochloride, mp 192-193 °C.
A 44 g portion of this hydrochloride was dissolved in an equal amount of water. Next, 50 ml of 20% aqueous NaOH was added and the mixture was thoroughly shaken. The free base 1-(dimethylamino)-2-chloropropane was insoluble in the aqueous alkaline solution. It was extracted with diethyl ether (2 × 100 ml). The combined etheral layers were dried over magnesium sulfate and evaporated to give 16 g of 1-(dimethylamino)-2-chloropropane as an oily residue.
2. Synthesis of 4-(dimethylamino)-2,2-diphenylpentane-1-nitrile6
A solution of diphenylacetonitrile (19.3 g, 0.1 mol) in 60 ml of dimethylformamide was added with stirring to a slurry of finely ground potassium hydroxide (11.2 g, 0.2 mol) in 40 ml of dimethylformamide under nitrogen. The dark red color of the nitrile anion was observed immediately. The mixture was heated to 75 °C, then 1-(dimethylamino)-2-chloropropane (14.85 g, 0.12 mol) was added at such a rate that the reaction temperature remained in the 75-80 °C range with external cooling when necessary. The reaction mixture was stirred at 75 °C under nitrogen for 1 h, cooled to room temperature and diluted with 250 ml of water. The aqueous mixture was extracted with benzene (3 × 150 ml). The extracts were combined and washed with water (400 ml) and brine (400 ml). They were dried over anhydrous sodium sulfate. Removal of the benzene under reduced pressure afforded 26.7 g of a crude mixture of isomeric nitriles, shown by GC analysis to contain 64.8% of 4-(dimethylamino)-2,2-diphenylpentane-1-nitrile, 34% of 4-(dimethylamino)-3-methyl-2,2-diphenylbutane-1-nitrile, and 0.35% of unreacted diphenylacetonitrile, the remainder of the material consisting of unidentifed volatile impurities.
The crude mixture thus obtained was dissolved in refluxing n-hexane (35 ml). Upon cooling in an ice bath, only 4-(dimethylamino)-2,2-diphenylpentane-1-nitrile crystallized. The solid was filtered off and recrystallized from n-hexane to afford 12.6 g of 99% pure product, mp 90-91 °C (45% yield based on diphenylacetonitrile).
3. Synthesis of 6-(dimethylamino)-4,4-diphenylheptan-3-one (methadone)6
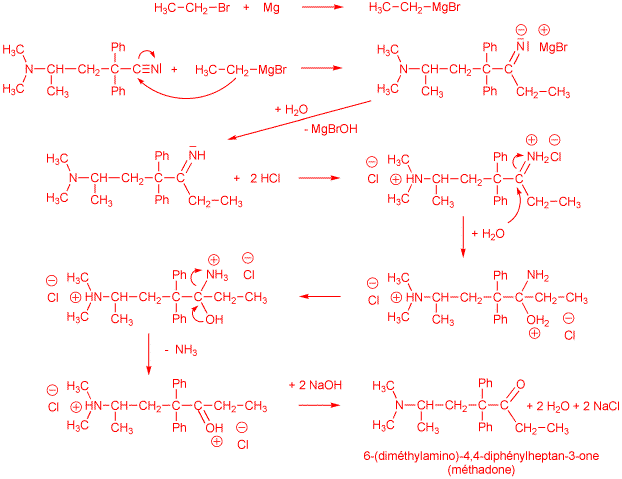
A 250 ml two-neck round-bottomed flask equipped with a dropping funnel, condenser, stirrer, and drying tubes, was charged with a solution of ethyl magnesium bromide (prepared from 1.8 g of magnesium and 8.8 g of ethyl bromide) in 10 ml of anhydrous diethyl ether. A solution of 4-(dimethylamino)-2,2-diphenylpentane-1-nitrile (10.2 g, 37 mmol) in 10 ml of hot anhydrous benzene (~65 °C) was added dropwise to the Grignard reagent over a 15 min period. The mixture was heated under reflux for 3 h. Next, the condenser was arranged for distillation and 60 ml of 10% aqueous HCl was added dropwise to the mixture. The organic solvent distilled from the reaction mixture by the heat of the ensuing vigorous reaction. The residue was transferred to a beaker and 20 ml of benzene were added, whereupon three layers formed. Upon standing, the methadone hydrochloride, which crystallized from the oily middle layer, was collected, dried, and dissolved in water. The aqueous solution was made alkaline with sodium hydroxide and then cooled. The free base separated as a solid and was recrystallized from methanol, giving 9.8 g (86% yield) of pure methadone, mp 77-79 °C.
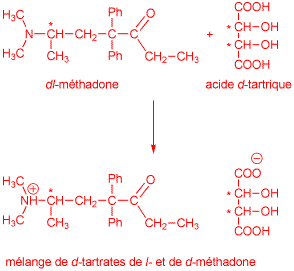
Pure l-methadone is 1.5-2.4 times more active than the racemic mixture, but this small difference usually does not warrant isomer separation. The separation is very easy to perform though, as treatment of racemic methadone base with d-tartaric acid (d-2,3-dihydroxy-1,4-butanedioic acid) in an acetone/water mixture precipitates almost solely the l-methadone d-tartrate, while the less potent d-methadone d-tartrate remains soluble in the mother liquor.7
1. M. Bockmühl, G. Ehrhart, Liebigs Ann. Chem. 561, 52-85 (1949).
2. J. Johnson, Chem. Eng. News 83, 20 June, 88 (2005).
3. S. Sleiman (Ed.), Belgian National Report on Drugs, Scientific Institute of Public Health: Brussels, IPH/EPI Report N° 2004 - 22 (2004).
4. Methadone, in Wikipedia Encyclopedia, http://en.wikipedia.org/wiki/Methadone.
5. E. M. Schultz, J. M. Sprague, J. Am. Chem. Soc. 70, 48-52 (1948).
6. C. Barnett, US Pat. 4,048,211 (1977); Chem. Abstr. 87, 201130 (1977).
7. A. A. Larsen, B. F. Tullar, B. Elpern, J. S. Buck, J. Am. Chem. Soc. 70, 4194-4197 (1948).
Nom : .............................
Prénom : ..........................
Sart-Tilman, le 21 novembre 2005
Sur base des modes opératoires ci-joints, répondez de façon brève, claire et précise aux questions suivantes. Vos réponses doivent se trouver uniquement dans les espaces prévus à cet effet, sur les faces recto des feuilles. Les faces verso peuvent être utilisées comme brouillons. Toutes vos équations chimiques doivent être complètes et équilibrées. Soignez les dessins de structures chimiques et de montages expérimentaux.
Etape 1. Synthèse du 1-(diméthylamino)-2-chloropropane
1) Proposez deux équations moléculaires équilibrées rendant compte de la transformation du 1-(diméthylamino)-2-propanol en 1-(diméthylamino)-2-chloropropane dans les conditions expérimentales adoptées. Indiquez clairement sur votre schéma les structures du réactif et du produit. (2 points)
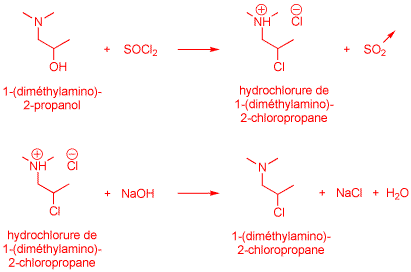
2) "Caution: work in an efficient fume hood": commentez cette mise en garde. (1 point)
La réaction s'accompagne de la libération d'un équivalent d'anhydride sulfureux (0.37 mol).
Une hotte efficace permet d'évacuer ce gaz irritant en toute sécurité.
Etape 2. Synthèse du 4-(diméthylamino)-2,2-diphénylpentane-1-nitrile
3) Proposez un mécanisme faisant intervenir un sel d'aziridinium pour rendre compte de la formation d'un mélange de 4-(diméthylamino)-2,2-diphénylpentane-1-nitrile et de 4-(diméthylamino)-3-méthyl-2,2-diphénylbutane-1-nitrile à partir de diphénylacétonitrile et de 1-(diméthyl-amino)-2-chloropropane dans les conditions expérimentales adoptées. Indiquez clairement sur votre schéma les structures des deux nitriles isomères. Justifiez brièvement la sélectivité observée. (4 points)
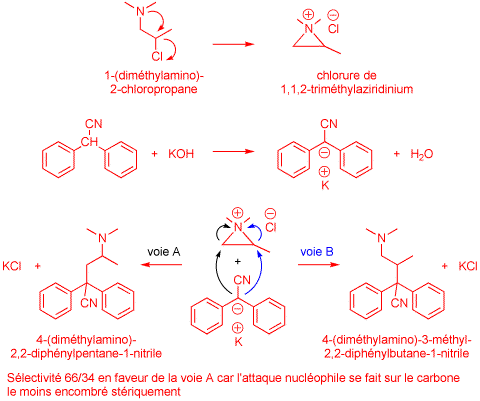
4) Expliquez pourquoi l'anion du diphénylacétonitrile est coloré alors que la molécule neutre est incolore. (1 point)
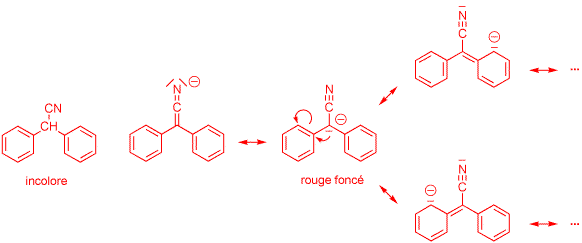
L'anion du diphénylacétonitrile possède de nombreuses formes de résonance permettant d'étendre la conjugaison des doubles liaisons. Son absorption UV-visible est déplacée vers le visible.
5) Il est possible d'augmenter la sélectivité de la réaction en faveur du 4-(diméthylamino)-2,2-diphénylpentane-1-nitrile en diminuant la température. Pour maintenir une vitesse de réaction satisfaisante, il est alors recommandé d'ajouter au milieu réactionnel une quantité catalytique de dibenzo-18-couronne-6. Représentez la structure de cet additif et expliquez son rôle dans la réaction. (3 points)
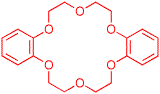
Le dibenzo-18-couronne-6 est un éther-couronne qui forme un complexe très stable avec les ions potassium. Il facilite le passage de l'hydroxyde de potassium en milieu organique et favorise la dissociation des paires d'ions, ce qui rend les anions plus nucléophiles. Il joue donc le rôle de catalyseur de transfert de phase et permet de compenser la diminution de vitesse de réaction provoquée par une baisse de température.
6) Pourquoi est-il préférable de ne plus employer le benzène comme solvant au laboratoire? Quel(s) autre(s) solvant(s) organique(s) usuel(s) utiliseriez-vous à la place? (2 points)
Le benzène possède une toxicité hématopoïétique élevée. Les effets possibles à long terme sont les leucémies et les syndromes myéloprolifératifs.
Le benzène peut souvent être remplacé par ses homologues supérieurs (toluène, éthylbenzène, xylènes).
7) Pourquoi est-il préférable de ne plus employer le n-hexane comme solvant au laboratoire? Quel(s) autre(s) solvant(s) organique(s) usuel(s) utiliseriez-vous à la place? (2 points)
La métabolisation du n-hexane par le foie conduit à la formation d'hexane-2,5-dione qui est un neurotoxique.
Le n-hexane peut être remplacé par ses homologues inférieurs et supérieurs (pentane et heptane), par du cyclohexane ou par de l'éther de pétrole.
8) Que désigne-t-on en anglais par "brine"? Quand l'utilise-t-on à la place d'eau pure pour effectuer un lavage? (2 points)
Il s'agit de saumure, c'est-à-dire une solution aqueuse saturée en chlorure de sodium. Sa force ionique très élevée réduit son pouvoir solvatant vis-à-vis de molécules organiques peu polaires (moins de pertes au lavage) et augmente sa densité (moins d'émulsions, meilleure séparation des phases).
Etape 3. Synthèse de la 6-(diméthylamino)-4,4-diphénylheptan-3-one (méthadone)
9) Proposez un mécanisme détaillé pour la transformation du 4-(diméthylamino)-2,2-diphénylpentane-1-nitrile en méthadone dans les conditions expérimentales adoptées. Indiquez clairement sur votre schéma la structure de la méthadone. (3 points)
10) Représentez schématiquement le montage expérimental initial que vous réaliseriez pour la synthèse de la méthadone. Expliquez schématiquement la modification à lui apporter par la suite pour distiller le solvant. (3 points)
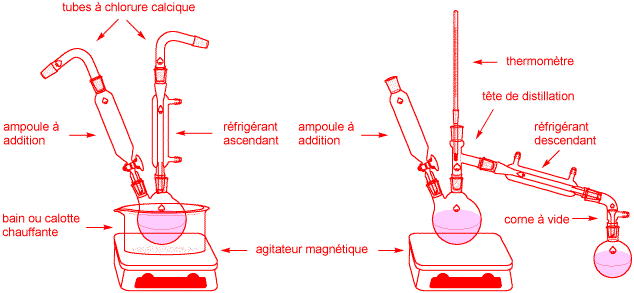
Dans la première partie de la réaction, (addition de EtMgBr sur un nitrile), on équipe le ballon d'une ampoule à additionner pour ajouter goutte à goutte la solution chaude de nitrile et d'un réfrigérant ascendant pour porter le mélange réactionnel à reflux au moyen d'un bain d'huile ou d'une calotte chauffante. Des tubes à chlorure calciques sont nécessaires pour protéger le dérivé organomagnésien de l'humidité.
Pour la seconde partie de la réaction (hydrolyse acide), les tubes à chlorure calcique et le dispositif de chauffage ne sont plus nécessaires et peuvent être retirés. L'ampoule à additionner est utilisée pour ajouter goutte à goutte l'acide chlorhydrique et le réfrigérant est mis en position descendante pour distiller le solvant.
11) Proposez une méthode simple pour amorcer la réaction du magnésium avec le bromure d'éthyle si elle ne démarre pas spontanément. (1 point)
Il est possible d'amorcer la réaction du magnésium avec le bromure d'éthyle en ajoutant un cristal d'iode ou quelques gouttes de tétrachlorure de carbone au milieu réactionnel.
12) Comment procéderiez-vous pour obtenir de l'éther diéthylique anhydre à partir d'une bouteille de solvant pour analyse? Quelle précaution faut-il prendre avant d'effectuer cette opération? (2 points)
L'éther diéthylique pour analyse peut être séché sur un fil de sodium puis distillé. Il est indispensable de s'assurer au préalable de l'absence de peroxydes.
En présence d'air et de lumière, l'éther diéthylique est lentement oxydé en peroxyde de diéthyle (Et2O3). S'il n'est pas détruit au préalable par un réducteur adéquat (par exemple un sel de fer(II), d'étain(II), ou du sulfite de sodium), ce composé instable et peu volatil s'accumule dans le résidu de distillation et peut conduire à une explosion.
13) Comment procéderiez-vous pour obtenir du benzène anhydre à partir d'une bouteille de solvant pour analyse? (1 point)
Le benzène pour analyse peut être séché avec un fil de sodium, de l'hydrure de lithium aluminium, de l'hydrure de calcium, du pentoxyde de phosphore ou du tamis moléculaire 5A suivi d'une distillation.
14) Expliquez brièvement le principe général d'une résolution racémique en prenant comme exemple la résolution de la méthadone par l'acide tartrique. Dans votre réponse, utilisez des formules planes pour représenter les molécules et marquez les centres chiraux par des astérisques. (3 points)
La méthadone est obtenue sous forme de mélange racémique de deux énantiomères respectivement dextro- et levogyres. Ce mélange peut être résolu par réaction acide-base avec de l'acide d-tartrique (un acide optiquement actif peu coûteux produit en grande quantité par l'industrie de vin). On obtient ainsi deux sels diastéréoisomères possédant des propriétés physico-chimiques différentes qui peuvent être aisément séparés par cristallisation fractionnée.
Retour au sommaire des interrogations Retour au sommaire de /licence/