Synthesis of albuterol, a bronchodilator used in the treatment of asthma
Introduction
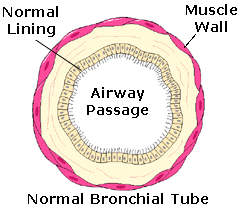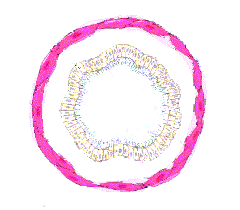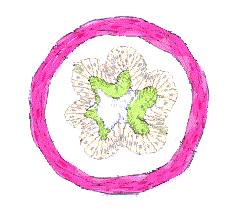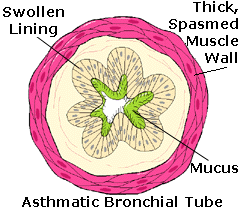 Albuterol (also known as salbutamol) is a drug used in the treatment of asthma, a chronic lung disease
caused by inflammation of the lower airways. Asthma causes the bronchial tubes to become sensitive, swollen
and inflamed, and thus causes hyper-responsiveness of tissues lining the bronchi to certain triggers.
The most serious symptom is the constriction of the smooth muscle lining the bronchi of the lungs. This reduces airflow and makes breathing hard or, in fatal cases, impossible. Affecting some 15 million Americans
and more than 3 million people in the UK, asthma continues to increase in both incidence and severity despite
vast improvements in both therapeutic options and understanding of the disease over the years. These increases have
yet to be adequately explained, but the number and frequency of hospitalizations due to asthma, along
with the attendant expenditures, continue to escalate. More people of all ages are being treated for asthma
now than ever, and the number of children receiving treatment is on the rise [1].
Albuterol (also known as salbutamol) is a drug used in the treatment of asthma, a chronic lung disease
caused by inflammation of the lower airways. Asthma causes the bronchial tubes to become sensitive, swollen
and inflamed, and thus causes hyper-responsiveness of tissues lining the bronchi to certain triggers.
The most serious symptom is the constriction of the smooth muscle lining the bronchi of the lungs. This reduces airflow and makes breathing hard or, in fatal cases, impossible. Affecting some 15 million Americans
and more than 3 million people in the UK, asthma continues to increase in both incidence and severity despite
vast improvements in both therapeutic options and understanding of the disease over the years. These increases have
yet to be adequately explained, but the number and frequency of hospitalizations due to asthma, along
with the attendant expenditures, continue to escalate. More people of all ages are being treated for asthma
now than ever, and the number of children receiving treatment is on the rise [1].
The causes of asthma are not fully understood. However, like its related allergic conditions eczema and hay
fever, asthma often runs in the family and may be inherited. There are probably several other environmental factors
that contribute to someone developing asthma, such as housing and diet. Intense exposure to allergens
and triggers (notably airborne chemical irritants or particles) can precipitate asthma. Smoking during pregnancy
also increases the chance of a child developing asthma. Contrary to one common misconception, there is no evidence
that traffic pollution causes asthma, although poor air quality can be a trigger [1].
 Albuterol is a potent, long-acting β-adrenoreceptor stimulant that is orally effective and shows high selectivity
on bronchial smooth muscle. Therefore, it acts as a bronchodilator. In other words, it dilates bronchial
airways by relaxing the surrounding bronchial muscles. Adrenaline too causes a dilatation of the airways and was used in treating asthma just after World War II. It has, however, two less desirable effects: the unwelcome
increases in blood pressure and heart rate. In biological terms, the reason for this is that adrenaline is acting
at two different protein receptor sites (α and β) in the body, whereas albuterol is more selective for the
β2-adrenoreceptors in the lungs. The inhaled form of albuterol starts working within 515 minutes and can
last up to 6 hours [2].
Albuterol is a potent, long-acting β-adrenoreceptor stimulant that is orally effective and shows high selectivity
on bronchial smooth muscle. Therefore, it acts as a bronchodilator. In other words, it dilates bronchial
airways by relaxing the surrounding bronchial muscles. Adrenaline too causes a dilatation of the airways and was used in treating asthma just after World War II. It has, however, two less desirable effects: the unwelcome
increases in blood pressure and heart rate. In biological terms, the reason for this is that adrenaline is acting
at two different protein receptor sites (α and β) in the body, whereas albuterol is more selective for the
β2-adrenoreceptors in the lungs. The inhaled form of albuterol starts working within 515 minutes and can
last up to 6 hours [2].
Put on the market just three years after its synthesis in 1969 [3], albuterol is still available today, under
the brand names Ventolin (Glaxo) and Proventil (Schering), among others. The credit for getting albuterol to market
so quickly goes to David Jack, one of the researchers involved in its discovery at Allen & Hanburys (part
of the Glaxo Group, now GlaxoSmithKline). "In the early stages, we experimented on one another",
he recalled at a Wellcome Trust oral history seminar in 2000. "I was the first to take albuterol by
inhalation and by mouth under the supervision of [our medical director]. He had the drug next under my supervision.
... Within a month, we knew the effective doses of albuterol, by inhalation and by mouth, the duration
of the action, and the probable use-limiting side effects. Thus, it took only six months from the date of first
synthesis to establish the probable efficiency and safety of the drug", he said. Jack also made the
decision to conduct the different development studies concurrently rather than sequentially, which saved
significant time [4].
Experimental Procedure [5]
1. General Information
All reagents were commercially available and used without
further purification. Melting points were taken on a Thomas-Hoover apparatus and are uncorrected. IR spectra
were recorded in KBr pellets on a Perkin-Elmer 1320 instrument. NMR spectra were recorded on a Bruker AM
250 spectrometer using TMS as internal standard.
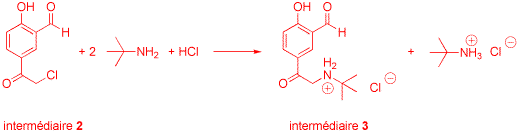
2. Synthesis of intermediate 2
To a suspension of anhydrous aluminum chloride (100 g, 0.75 mol) in dichloromethane (125 mL) at reflux
is added chloroacetyl chloride (28.2 g, 0.25 mol). After 30 min, salicylaldehyde (1, 24.4 g, 0.2 mol)
is added dropwise. The mixture is heated at reflux for 18 h. It is then carefully poured onto ice (1 kg),
water (100 mL), and dichloromethane (100 mL). The organic layer is separated and the aqueous layer is extracted
with dichloromethane (3 x 150 mL). The organic phases are combined, washed with water (2 x 250 mL) and brine (500 mL), dried over MgSO4, and evaporated under reduced pressure. The residue is recrystallized from hot 2-butanone (70 mL) to give 2. Yield: 16 g (40%), m.p. 133-134 °C.
3. Synthesis of intermediate 3
Compound 2 (10.0 g, 50.4 mmol) is suspended in 2-propanol (60 mL) with stirring under inert atmosphere. tert-Butylamine (11.4 g, 156 mmol) is added and the mixture is heated at reflux for 1 h. It is then treated with 6 M aqueous HCl (26 mL, 156 mmol) and 2-propanol (20 mL). After stirring for a further 18 h and cooling to room temperature, a solid is isolated by filtration. It is washed with diethyl ether (50 mL) and dried under vacuum at 50 °C to give intermediate 3. Yield: 6.2 g (46%), m.p. > 230 °C (dec.).
4. Synthesis of 4-(2-(tert-butylamino)-1-hydroxyethyl)-2-(hydroxymethyl)phenol
(albuterol) 4
Intermediate 3 (0.774 g, 2.85 mmol) is dissolved in anhydrous methanol (20 mL) at 0 °C and treated with
sodium methoxide (0.154 g, 2.85 mmol) with stirring. After 5 min, 5% palladium on carbon (0.23 g) is added
and the mixture is hydrogenated at 60 psi in an autoclave for 10 h. The suspension is filtered through a pad
of Celite and the filtrate is evaporated. The residue is recrystallized from ethyl acetate/cyclohexane to
give albuterol 4. Yield: 0.6 g (89%), m.p. 157-158 °C.
Bibliography
[1] J. Hettich, The Chemistry, Biochemistry, and Application of Salbutamol, http://www.ch.ic.ac.uk/local/projects/j_hettich/+start.html
[2] C. O'Driscoll, Chem. Brit. 2001, 37, September, 4042;
available online at http://www.chemsoc.org/chembytes/ezine/2001/newton_sep01.htm.
[3] D. T. Collin, D. Hartley, D. Jack, L. H. C. Lunts, J. C. Press, A. C. Ritchie, P. Toon, J. Med. Chem.
1970, 13, 674-680.
[4] C. Marasco, Chem. Eng. News 2005, 83, June 20, 114.
[5] E. Babad, N. I. Carruthers, R. S. Jaret, M. Steinman, Synthesis 1988, 966-968.
Nom : .............................
Prénom : ..........................
Sart-Tilman, le 4 décembre 2006
Seconde licence en sciences chimiques 2006-2007
Chimie organique
Interrogation de travaux pratiques
Sur base des modes opératoires ci-joints, répondez de façon brève, claire et précise aux questions suivantes. Vos réponses doivent se trouver uniquement dans les espaces prévus à cet effet, sur les faces recto des feuilles. Les faces verso peuvent être utilisées comme brouillons. Toutes vos équations chimiques doivent être complètes et équilibrées. Soignez les dessins de structures chimiques et de montages expérimentaux.
Thème I. Techniques d'analyse
1) Quand dit-on qu'un point de fusion est non-corrigé?
Décrivez succinctement la façon dont vous procéderiez pour le corriger (2 points).
Un point de fusion est dit non-corrigé lorsqu'il est enregistré au moyen d'un appareil dont le
thermomètre n'a pas fait l'objet d'un étalonnage préalable à la mesure. Une correction
peut être appliquée en utilisant une courbe de calibration établie pour des substances étalon
de points de fusion connus, proches du point de fusion à déterminer.
2) Décrivez succinctement la façon dont vous procéderiez pour préparer une pastille
de KBr en vue d'une analyse IR (2 points).
Avec une balance analytique, peser environ 1 mg de produit et 100 mg de KBr préalablement séché
à l'étuve. Broyer finement le mélange dans un mortier en agate. Transférer la poudre obtenue dans un moule et placer le piston. A l'aide d'une presse hydraulique, compresser la pastille quelques minutes sous vide puis démouler précautionneusement.
3) Décrivez succinctement la façon dont vous procéderiez pour préparer un tube en vue d'une analyse RMN (2 points).
Dans un tube propre et sec en verre parfaitement rectiligne de 5 mm de diamètre, placer une vingtaine de
milligrammes ou quelques gouttes de produit à analyser. Ajouter environ 0,4 mL d'un solvant deutéré
adéquat contenant quelques pour cent de tetraméthylsilane (TMS, référence interne). Boucher le tube au moyen d'un capuchon en plastique et homogénéiser la solution.
Thème II. Synthèse de l'intermédiaire 2
4) Proposez un mécanisme détaillé pour la transformation du salicylaldéhyde 1
en intermédiaire 2 dans les conditions expérimentales adoptées. Indiquez clairement sur votre schéma
le nom de la réaction et la structure de l'intermédiaire 2. Justifiez la quantité de chlorure d'aluminium
mise en oeuvre pour effectuer cette transformation (4 points).
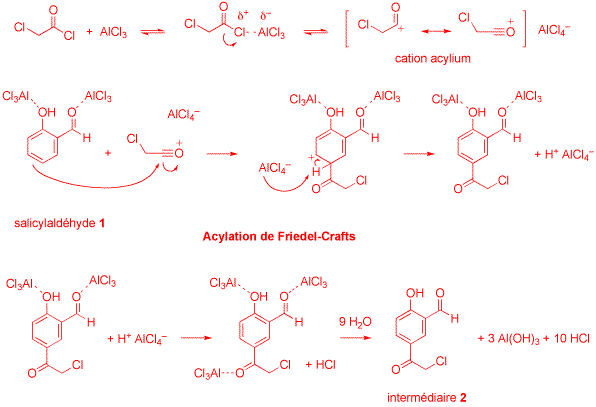
La complexation par les paires libres des oxygènes annihile le pouvoir catalytique du chlorure d'aluminium,
de sorte que trois équivalents de cet acide de Lewis sont nécessaires pour mener la réaction à son terme.
5) "The mixture ... is carefully poured onto ice":
commentez cette mise en garde (2 points).
L'hydrolyse de chlorure d'aluminium anhydre ou de chloroaluminates organiques est une réaction très exothermique
qui s'accompagne d'un dégagement gazeux de HCl. Le mélange réactionnel doit être versé lentement et avec précaution sur
de la glace plutôt que sur de l'eau pour éviter tout emballement de la réaction et limiter les
projections acides, d'autant plus qu'une quantité relativement importante d'AlCl3 (100 g) a été utilisée.
6) Que désigne-t-on en anglais par "brine"? Comment en prépareriez-vous 500 mL? (2 points)
Il s'agit de saumure, c'est-à-dire une solution aqueuse saturée en chlorure de sodium. Elle
est préparée en ajoutant une quantité suffisante de NaCl dans 500 mL d'eau pour qu'il reste
du solide non dissout en équilibre avec la solution. La solubilité de NaCl étant de 357 g/L
à 25 °C, il faudra en utiliser environ 180 g pour un demi-litre d'eau. Du sel de cuisine convient
parfaitement pour cette application, il n'est pas nécessaire d'employer du chlorure de sodium pour analyse beaucoup
plus cher.
Thème III. Synthèse de l'intermédiaire 3
7) Proposez une équation moléculaire équilibrée pour la transformation de l'intermédiaire 2
en intermédiaire 3. Indiquez clairement sur votre schéma la structure de ce dernier (3 points).
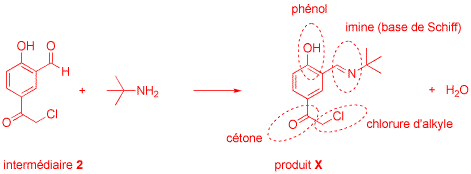
8) Si l'on fait réagir l'intermédiaire 2 avec un équivalent de tert-butylamine, on
isole un produit X fondant à 123-124 °C (rendement: 75%). Ce produit peut ensuite être converti en
intermédiaire 3 par réaction avec deux équivalents de tert-butylamine suivie d'une
hydrolyse acide. Proposez une équation moléculaire équilibrée pour la transformation de
l'intermédiaire 2 en produit X. Indiquez clairement sur votre schéma la structure de ce dernier.
Encerclez sur votre dessin tous les groupes fonctionnels qu'il contient et nommez les (4 points).
9) "m.p. > 230 °C (dec.)": que signifie cette notation? Comparez le point de fusion de l'intermédiaire
3 à celui de l'albuterol 4 (3 points).
L'intermédiaire 3 a un point de fusion supérieur à 230 °C et se décompose sous l'action
de la chaleur tandis que l'albuterol 4 se liquéfie entre 157 et 158 °C sans se dégrader. Cette
différence de comportement est principalement due au fait que l'intermédiaire 3 est un composé
ionique (un chlorure de dialkylammonium) tandis que l'albuterol 4 est un composé covalent. Dans
le premier cas, des interactions coulombiennes fortes assurent la cohésion du réseau cristallin
tandis dans le second, seules des forces de Van der Waals plus faibles maintiennent l'assemblage des molécules
entre elles.
10) Comment prépareriez-vous 26 mL d'HCl 6 M à partir d'acide chlorhydrique concentré? (2 points)
L'acide chlorhydrique concentré a une concentration d'environ 36% en masse dans l'eau, ce qui correspond
à une solution à peu près 12 M. Pour préparer 26 mL d'HCl 6 M, il faut donc verser lentement 13 mL d'acide concentré dans
13 mL d'eau ou 13 g de glace. Le mélange est exothermique. Il faut ensuite attendre que la solution
revienne à la température ambiante.
Thème IV. Synthèse de l'albuterol 4
11) Représentez tous les stéréoisomères possibles de l'albuterol 4 en indiquant leurs configurations
absolues. Le(s)quel(s) avez-vous obtenu(s)? Justifiez tous les éléments de votre réponse (4 points).
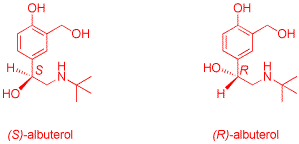
L'albuterol comporte un carbone asymétrique et existe donc sous la forme de deux énantiomères.
La configuration absolue du centre chiral est déterminée en appliquant les règles de Cahn, Ingold et
Prelog. La première étape consiste à classer les quatre substituants par ordre de priorité
décroissante en suivant des règles séquentielles. L'oxygène a un numéro atomique supérieur
au carbone et vient en première position. Les groupements CH2N et phényle viennent ensuite.
Ils sont départagés en examinant les atomes liés aux carbones voisins du centre chiral.
Le groupe CH2N (liaison avec un azote) est prioritaire par rapport au phényle (trois liaisons formelles
C-C). L'hydrogène est le substituant le moins prioritaire. Il est positionné de manière
à se trouver le plus loin possible de l'oeil de l'observateur qui examine le sens de rotation correspondant
au passage 1 vers 2 vers 3. Dans le cas de l'énantiomère S (du latin sinister,
gauche), la rotation se fait dans le sens contraire des aiguilles d'une montre, le sens des aiguilles d'une
montre correspondant à l'énantiomère R (du latin rectus, droit).
La voie de synthèse choisie pour la préparation de l'albuterol ne fait intervenir aucun réactif ou catalyseur optiquement actif. Elle conduit donc à un mélange racémique. Les deux énantiomères R et S sont obtenus en proportions équimolaires.
12) Comment procéderiez-vous pour préparer du méthanol anhydre à partir d'une bouteille de solvant pour analyse? (2 points)
Le méthanol peut être rendu anhydre par distillation fractionnée à condition
d'utiliser une colonne très efficace. La fraction de point d'ébullition 65 °C/760 mm Hg est collectée
et conservée sur tamis moléculaire 3A. Alternativement, le méthanol peut être
déshydraté par réaction avec du magnésium activé par quelques cristaux d'iode selon les équations ci-dessous puis distillé
et conservé sur tamis moléculaire 3A.
Mg + 2 MeOH --> H2 + Mg(OMe)2
Mg(OMe)2 + H2O --> Mg(OH)2 + 2 MeOH
13) Qu'appelle-t-on de la Célite? A quoi sert-elle? (3 points)
La Célite® est le nom commercial d'une forme naturelle de silice appelée kieselguhr, terre
d'infusoire ou terre de diatomée. Elle est extraite de dépôs sédimentaires formés
à partir des restes d'algues unicellulaires et est disponible en grandes quantités à
faible coût. La Célite est un solide microporeux possédant une surface spécifique élevée,
une bonne perméabilité, une grande capacité d'absorption d'eau et un faible pouvoir abrasif. Elle
est utilisée comme aide à la filtration pour prévenir le colmatage des filtres et retenir
les particules fines ou colloïdales. Dans la synthèse de l'albuterol 4, son emploi facilite l'élimination du palladium sur charbon actif.
14) Expliquez, étape par étape, la façon dont vous procéderiez pour recristalliser l'albuterol
au moyen d'acétate d'éthyle et de cyclohexane (5 points).
1. Dissoudre l'albuterol dans un minimum d'acétate d'éthyle à reflux (l'acétate d'éthyle est relativement polaire et est un bon solvant pour l'albuterol également polaire)
2. Eventuellement filtrer à chaud les impuretés insolubles (résidus de Célite et/ou de palladium sur charbon actif)
3. Tout en maintenant le reflux, ajouter du cyclohexane goutte à goutte jusqu'à l'apparition d'un léger trouble (le cyclohexane est un hydrocarbure aliphatique non polaire, c'est un mauvais solvant pour l'albuterol)
4. Rajouter un peu d'acétate d'éthyle pour que la solution redevienne limpide
5. Refroidir lentement la solution pour provoquer la cristallisation de l'albuterol
6. Eventuellement, si la cristallisation ne se produit pas spontanément, l'amorcer en grattant la paroi
du récipient, en ajoutant un cristal préexistant, en mettant au congélateur,...
7. Filtrer les cristaux obtenus et les rincer avec un peu de cyclohexane froid
8. Sécher les cristaux à l'air ou sous vide en chauffant éventuellement mais sans dépasser la température de fusion
Retour au sommaire des interrogations Retour au sommaire de /licence/
 Albuterol (also known as salbutamol) is a drug used in the treatment of asthma, a chronic lung disease
caused by inflammation of the lower airways. Asthma causes the bronchial tubes to become sensitive, swollen
and inflamed, and thus causes hyper-responsiveness of tissues lining the bronchi to certain triggers.
The most serious symptom is the constriction of the smooth muscle lining the bronchi of the lungs. This reduces airflow and makes breathing hard or, in fatal cases, impossible. Affecting some 15 million Americans
and more than 3 million people in the UK, asthma continues to increase in both incidence and severity despite
vast improvements in both therapeutic options and understanding of the disease over the years. These increases have
yet to be adequately explained, but the number and frequency of hospitalizations due to asthma, along
with the attendant expenditures, continue to escalate. More people of all ages are being treated for asthma
now than ever, and the number of children receiving treatment is on the rise [1].
Albuterol (also known as salbutamol) is a drug used in the treatment of asthma, a chronic lung disease
caused by inflammation of the lower airways. Asthma causes the bronchial tubes to become sensitive, swollen
and inflamed, and thus causes hyper-responsiveness of tissues lining the bronchi to certain triggers.
The most serious symptom is the constriction of the smooth muscle lining the bronchi of the lungs. This reduces airflow and makes breathing hard or, in fatal cases, impossible. Affecting some 15 million Americans
and more than 3 million people in the UK, asthma continues to increase in both incidence and severity despite
vast improvements in both therapeutic options and understanding of the disease over the years. These increases have
yet to be adequately explained, but the number and frequency of hospitalizations due to asthma, along
with the attendant expenditures, continue to escalate. More people of all ages are being treated for asthma
now than ever, and the number of children receiving treatment is on the rise [1]. Albuterol is a potent, long-acting β-adrenoreceptor stimulant that is orally effective and shows high selectivity
on bronchial smooth muscle. Therefore, it acts as a bronchodilator. In other words, it dilates bronchial
airways by relaxing the surrounding bronchial muscles. Adrenaline too causes a dilatation of the airways and was used in treating asthma just after World War II. It has, however, two less desirable effects: the unwelcome
increases in blood pressure and heart rate. In biological terms, the reason for this is that adrenaline is acting
at two different protein receptor sites (α and β) in the body, whereas albuterol is more selective for the
β2-adrenoreceptors in the lungs. The inhaled form of albuterol starts working within 515 minutes and can
last up to 6 hours [2].
Albuterol is a potent, long-acting β-adrenoreceptor stimulant that is orally effective and shows high selectivity
on bronchial smooth muscle. Therefore, it acts as a bronchodilator. In other words, it dilates bronchial
airways by relaxing the surrounding bronchial muscles. Adrenaline too causes a dilatation of the airways and was used in treating asthma just after World War II. It has, however, two less desirable effects: the unwelcome
increases in blood pressure and heart rate. In biological terms, the reason for this is that adrenaline is acting
at two different protein receptor sites (α and β) in the body, whereas albuterol is more selective for the
β2-adrenoreceptors in the lungs. The inhaled form of albuterol starts working within 515 minutes and can
last up to 6 hours [2].