Nom : ...............................
Prénom : ..........................
Sart-Tilman, le 8 janvier 2007
En vous aidant du tableau périodique fourni, répondez de façon brève, claire et précise aux questions suivantes. Vos réponses doivent se trouver uniquement dans les espaces prévus à cet effet, sur les faces recto des feuilles, les faces verso peuvent être utilisées comme brouillons. Soignez les dessins des structures chimiques.
Données: cod = 1,5-cylooctadiène, dmpe = 1,2-bis(diméthylphosphino)éthane
Question 1. Proposez une structure plausible pour les complexes suivants. Représentez clairement sur votre schéma la géométrie autour du métal, les liaisons avec les ligands et les liaisons métal-métal éventuelles. Déterminez le nombre d'électrons périphériques des complexes en indiquant le détail de vos calculs. (10 points)
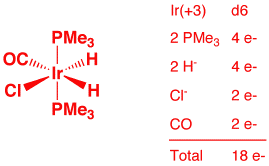
a) Ir(H)2Cl(CO)(PMe3)2 (2 points)

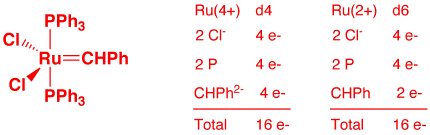
b) Cl2Ru(=CHPh)(PPh3)2 (2 points)
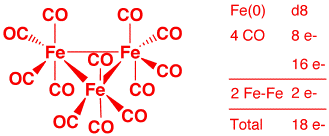
c) Fe3(CO)12 (2 points)
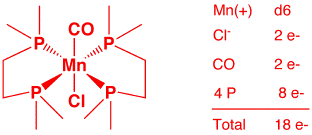
d) MnCl(CO)(dmpe)2 (2 points)
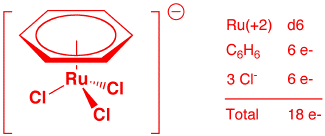
e) [RuCl3(η6-C6H6)]— (2 points)
Question 2. Dans chacune des paires suivantes, encerclez le complexe qui devrait posséder la fréquence d'élongation νCO la plus basse en spectroscopie infrarouge. Expliquez brièvement votre raisonnement pour chaque cas. (6 points)
a) CpV(CH3)2(CO) -ou- Cp2YCl(CO) (2 points)
CpV(CH3)2(CO)
V3+ d2 14 e- Y3+ d0 16 e-
Y a une structure d0 -> pas de rétrodonation possible
V a une structure d2 et de bons groupes donneurs Cp et Me -> abaissement de la fréquence νCO
b) Cr(CO)4(PMe3)2 -ou- W(CO)4(dmpe) (2 points)
W(CO)4(dmpe)
Cr0 d6 18 e- W0 d6 18 e-
Un ligand dmpe est approximativement équivalent à 2 PMe3. La principale différence entre les deux complexes est que W est moins électronégatif que Cr -> cédera plus facilement ses e-
c) [CpFe(CO)2(PPh3)]+ -ou- [CpOs(CO)(PEt3)2]+ (2 points)
[CpOs(CO)(PEt3)2]+
Fe2+ d6 18 e- Os2+ d6 18 e-
Os a 2 bons donneurs PEt3 pour un seul CO
Fe a 1 seul donneur PPh3 pour 2 CO
En outre, Os est moins électronégatif que Fe
Question 3. Dans chacune des paires suivantes, encerclez le complexe qui devrait posséder le pKa le plus bas. Expliquez brièvement votre raisonnement pour chaque cas. (6 points)
a) HRh(CO)(PMe3)2 -ou- HIr(CO)(cod) (2 points)
HIr(CO)(cod)
Rh+ d8 16 e- Ir+ d8 16 e-
Les deux ligands PMe3 sont de bien meilleurs donneurs que le diène -> compensent largement la différence d'électronégativité et rendent l'H du Rh hydrique et pas acide
b) CpRuH(CO)2 -ou- CpWH(CO)2(PMe3) (2 points)
CpRuH(CO)2
Ru2+ d6 18 e- W2+ d4 16 e-
W a un ligand PMe3 bon donneur et est moins électronégatif que Ru -> les deux effets vont dans le même sens, ils rendent Ru plus électrodéficient et son H plus acide
c) Cp2Ti(H)2 -ou- Cp*2W(H)2 (2 points)
Cp2Ti(H)2
Ti4+ d0 16 e- W4+ d2 18 e-
Ti a des ligands Cp moins bons donneurs que Cp* (variation d'électronégativité difficile à prévoir)
Question 4. Indiquez pour chacune des réactions suivantes les étapes élémentaires qui la composent et l'ordre dans lequel ces étapes se déroulent. (6 points)
a) Cp*Ir(CO)2 + CH4 ![]() Cp*IrH(CO)(CH3) + CO (2 points)
Cp*IrH(CO)(CH3) + CO (2 points)
1. dissociation de CO (passage de 18 à 16 e-)
2. addition oxydante de CH4 (substrat non-électrophile de classe A, requiert une orbitale vacante)
b) (H)2RhCl(PPh3)2(CH2CH3) ![]() HRhCl(PPh3)2 + CH3CH3 (2 points)
HRhCl(PPh3)2 + CH3CH3 (2 points)
Rh4+ -> Rh2+
élimination réductrice de H- et Et- cisoïdes pour donner C2H6 (il peut aussi y avoir dissociation préalable de PPh3 ou Cl- pour rendre le métal plus électrodéficient mais le ligand doit alors être réassocié après l'ER)
c) HRh(CO)(PPh3)2 + CO + H2C=CH2 ![]() Rh(COCH2CH3)(CO)(PPh3)2 (2 points)
Rh(COCH2CH3)(CO)(PPh3)2 (2 points)
1. addition de C2H4
2. insertion migratoire de H- et C2H4 pour donner C2H5-
3. addition de CO
4. insertion migratoire de C2H5- et CO
Question 5. Dans chacune des paires suivantes, encerclez le complexe qui réagira le plus facilement par addition oxydante avec le substrat indiqué. Expliquez brièvement votre raisonnement pour chaque cas. (6 points)
a) H2: CpIr(dmpe) -ou- RhCl(CO)(PPh3)2 (2 points)
RhCl(CO)(PPh3)2
Ir+ d8 18 e- Rh+ d8 16 e-
Ir: complexe à 18 e- avec des ligands très bons donneurs, peu susceptibles de se dissocier pour libérer une vacance
Rh: complexe à 16 e-, OK pour H2
b) CH3I: [Re(CO)3(dmpe)]— -ou- [Re(CO)3(Pt-Bu3)2]— (2 points)
[Re(CO)3(dmpe)]—
Re- d8 18 e- Re- d8 18 e-
électroniquement, les deux complexes sont semblables, 18 e- OK avec CH3I mais la tri-tert-butylphosphine est très volumineuse et gêne l'approche de CH3I
c) CH3Br: Pt(dmpe)(H2C=CH2)2 -ou- [Ir(CF3)3(PPh3)2]+ (2 points)
Pt(dmpe)(H2C=CH2)2
Pt0 d10 18 e- Ir4+ d5 15 e-
Pt: deux alkylphosphines très bons donneurs
Ir: mauvais donneurs, état d'oxydation déjà élevé (+4) et seulement 15 e- -> plus difficile à oxyder
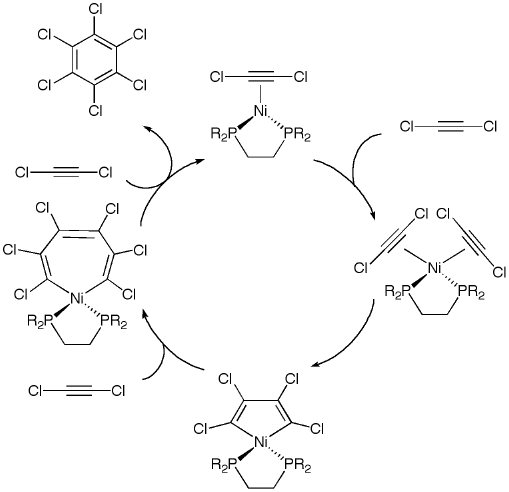
Question 6. Commentez brièvement le cycle catalytique suivant en indiquant pour chaque étape la nature des réactions chimiques élémentaires qui la composent et l'ordre dans lequel elles se déroulent. Pour étayer votre raisonnement, indiquez à proximité de chaque atome de nickel son état d'oxydation et son nombre d'électrons de valence. (6 points)