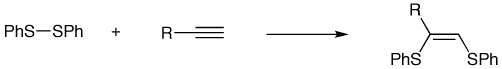
Nom : ...............................
Prénom : ..........................
Sart-Tilman, le 7 janvier 2008
En vous aidant du tableau périodique fourni, répondez de façon brève, claire et précise aux questions suivantes. Vos réponses doivent se trouver uniquement dans les espaces prévus à cet effet, sur les faces recto des feuilles, les faces verso peuvent être utilisées comme brouillons. Soignez les dessins des structures chimiques.
| Données: | dmpe = 1,2-bis(diméthylphosphino)éthane |
| dppe = 1,2-bis(diphénylphosphino)éthane |
Question 1. Proposez une structure plausible pour les complexes suivants. Représentez clairement sur votre schéma la géométrie autour du métal, les liaisons avec les ligands et les liaisons métal-métal éventuelles. Déterminez le nombre d'électrons périphériques des complexes en indiquant le détail de vos calculs. (10 points)
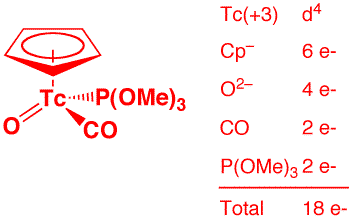
a) CpTc(O)(CO)P(OMe)3 (2 points)

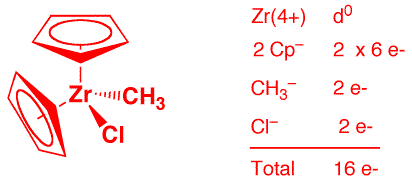
b) Cp2Zr(CH3)Cl (2 points)
c) Ni(CH3-C![]() C-CH3)2 (2 points)
C-CH3)2 (2 points)
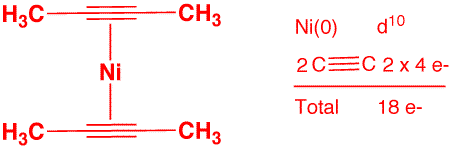
d) [Re(CO)4(μ-PMe2]2 (2 points)
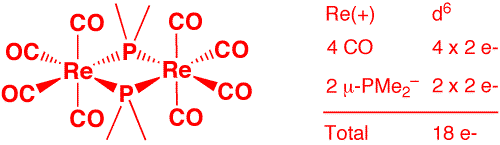
e) [CpOs(H)(η3-allyl)(PPh3)]+ (2 points)
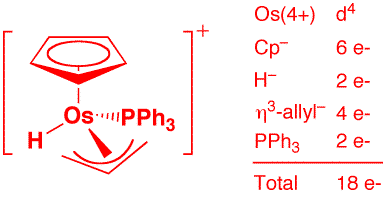
Question 2. Dans chacune des paires suivantes, encerclez le complexe qui devrait posséder la liaison double M=C la plus forte. Expliquez brièvement votre raisonnement pour chaque cas. (6 points)
a) Cp2BrTa=CH2 -ou- [Cp(CO)2Ru=CH2]+ (2 points)
Cp2BrTa=CH2 (alkylidène de Schrock)
b) [(CO)5V=C(NMe2)2]- -ou- Cp(PMe3)2Re=CH2 (2 points)
Cp(PMe3)2Re=CH2
V: rétrodonation π vers les CO
Re: PMe3 et Cp bons donneurs -> rétrodonation vers CH2
c) [Cp(dppe)Fe=CPh2]+ -ou- Cp(O)Nb=CH2 (2 points)
Cp(O)Nb=CH2 (alkylidène de Schrock)
complexe de fer: carbène de Fischer
Question 3. Dans chacune des paires suivantes, encerclez le complexe qui devrait posséder le pKa le plus bas. Expliquez brièvement votre raisonnement pour chaque cas. (6 points)
a) [HOs(PMe3)(dmpe)2]+ -ou- HRe(CF3)2(CO)2{P(OMe)3}2 (2 points)
HRe(CF3)2(CO)2{P(OMe)3}2
Re a des ligands bons π-accepteurs (2 CO, 2 phosphites) tandis que Os a 5 bons donneurs -> Re sera plus à même de stabiliser la charge négative laissée par le départ du proton, malgré le fait que l'on formera un complexe chargé plutôt que neutre.
b) [HCoCl(NH3)4]+ -ou- CpFe(H)(dppe) (2 points)
[HCoCl(NH3)4]+
Co(+3) a des ligands mauvais donneurs et une charge positive. Il sera donc plus apte à perdre un proton pour récupérer une charge négative et abaisser son état d'oxydation que le fer qui est lié à un très bon donneur (Cp-) et un donneur moyen (dppe).
c) HRh(CO)(PPh3)2 -ou- HRh(CO)2{P(OPh)3} (2 points)
HRh(CO)2{P(OPh)3}
Le second complexe a les meilleurs accepteurs π (2 CO et 1 phosphite) qui le rendent plus électro-déficient et capable de stabiliser la charge négative laissée par le départ du proton.
Question 4. Dans chacune des paires suivantes, encerclez le complexe qui réagira le plus facilement par addition oxydante avec le substrat indiqué. Expliquez brièvement votre raisonnement pour chaque cas. (6 points)
a) H2: [Co(dmpe)2]+ -ou- [Rh(dppe)2]+ (2 points)
[Co(dmpe)2]+
Le ligand dmpe est un meilleur donneur que le dppe, ce qui rend le complexe de Co plus facile à oxyder malgré le fait que ce métal soit plus électronégatif que Rh. Les deux complexes ont 16 e-, une condition nécessaire pour réagir avec H2.
b) HSiMe3: Co(CO)(PEt3)2Cl -ou- Ir(CO)(PMe3)2Br (2 points)
Ir(CO)(PMe3)2Br
L'iridium est moins électronégatif que le cobalt et le bromure est un meilleur donneur que le chlorure. La triéthylphosphine est un peu meilleur donneur que la triméthylphosphine mais ceci ne compensera pas les deux effets précédents.
c) CH3Cl: Cr(CO)6 -ou- W(![]() CH)(CH3)3(dmpe) (2 points)
CH)(CH3)3(dmpe) (2 points)
Cr(CO)6
Le complexe de tungstène est d0 et ne peut plus être oxydé. CH3Cl est un substrat électrophile qui n'a pas besoin d'une orbitale vacante pour se coordiner au chrome -> 18 e- OK.
Question 5. Pour chacune des réactions suivantes, deux mécanismes vous sont proposés. Encerclez celui qui vous paraît le plus probable. Justifiez brièvement votre choix dans chaque cas. (6 points)
a) [CpOs(CO)3]+ + PMe3 ![]() [CpOs(CO)2(PMe3)]+ + CO (2 points)
[CpOs(CO)2(PMe3)]+ + CO (2 points)
[CpOs(CO)3]+ ![]() [CpOs(CO)2]+ + CO
[CpOs(CO)2]+ + CO
[CpOs(CO)2]+ + PMe3 ![]() [CpOs(CO)2(PMe3)]+
[CpOs(CO)2(PMe3)]+
-ou-
[CpOs(CO)3]+ + PMe3 ![]() [CpOs(CO)3(PMe3)]+
[CpOs(CO)3(PMe3)]+
[CpOs(CO)3(PMe3)]+ ![]() [CpOs(CO)2(PMe3)]+ + CO
[CpOs(CO)2(PMe3)]+ + CO
premier mécanisme: passage de 18 e- à 16 e- puis de 16 e- à 18 e-
second mécanisme: passage de 18 e- à 20 e- puis de 20 e- à 18 e-
La dissociation d'un ligand CO à partir d'un complexe cationique à 18 e- est plus probable que le passage par un intermédiaire à 20 e- -> réponse 1
b) (η3-allyl)Re(dmpe)(PPh3)2 + CO ![]() (η3-allyl)Re(dmpe)(PPh3)(CO) + PPh3 (2 points)
(η3-allyl)Re(dmpe)(PPh3)(CO) + PPh3 (2 points)
(η3-allyl)Re(dmpe)(PPh3)2 ![]() (η3-allyl)Re(η1-dmpe)(PPh3)2
(η3-allyl)Re(η1-dmpe)(PPh3)2
(η3-allyl)Re(η1-dmpe)(PPh3)2 + CO ![]() (η3-allyl)Re(η1-dmpe)(PPh3)2(CO)
(η3-allyl)Re(η1-dmpe)(PPh3)2(CO)
(η3-allyl)Re(η1-dmpe)(PPh3)2(CO) ![]() (η3-allyl)Re(dmpe)(PPh3)(CO) + PPh3
(η3-allyl)Re(dmpe)(PPh3)(CO) + PPh3
-ou-
(η3-allyl)Re(dmpe)(PPh3)2 ![]() (η1-allyl)Re(dmpe)(PPh3)2
(η1-allyl)Re(dmpe)(PPh3)2
(η1-allyl)Re(dmpe)(PPh3)2 + CO ![]() (η1-allyl)Re(dmpe)(PPh3)2(CO)
(η1-allyl)Re(dmpe)(PPh3)2(CO)
(η1-allyl)Re(dmpe)(PPh3)2(CO) ![]() (η3-allyl)Re(dmpe)(PPh3)(CO) + PPh3
(η3-allyl)Re(dmpe)(PPh3)(CO) + PPh3
premier mécanisme: passage de 18 e- à 16 e- puis de 16 e- à 18 e- et enfin de 18 e- à 18 e-
second mécanisme: passage de 18 e- à 16 e- puis de 16 e- à 18 e- et enfin de 18 e- à 18 e-
Le shift η3 vers η1 est plus facile à réaliser que la décoordination d'une des deux extrémités de la phosphine chélatante -> réponse 2
c) Cp2Zr(PMe3)2 + H2 ![]() Cp2Zr(H)2(PMe3) + PMe3 (2 points)
Cp2Zr(H)2(PMe3) + PMe3 (2 points)
Cp2Zr(PMe3)2 ![]() Cp2Zr(PMe3) + PMe3
Cp2Zr(PMe3) + PMe3
Cp2Zr(PMe3) + H2 ![]() Cp2Zr(H)2(PMe3)
Cp2Zr(H)2(PMe3)
-ou-
Cp2Zr(PMe3)2 + H2 ![]() Cp2Zr(H)2(PMe3)2
Cp2Zr(H)2(PMe3)2
Cp2Zr(H)2(PMe3)2 ![]() Cp2Zr(H)2(PMe3) + PMe3
Cp2Zr(H)2(PMe3) + PMe3
premier mécanisme: passage de 18 e- à 16 e- puis de 16 e- à 18 e-
second mécanisme: passage de 18 e- à 20 e- puis de 20 e- à 18 e-
L'addition oxydante de l'hydrogène n'est pas possible sur un complexes à 18 e- -> réponse 1
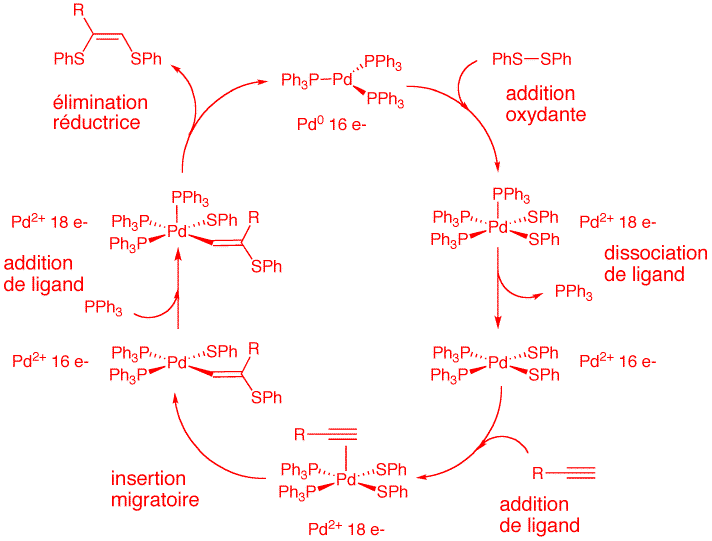
Question 6. Proposez un cycle catalytique plausible pour effectuer la réaction de double thiolation d'un alcyne par un disulfure représentée ci-dessous en utilisant Pd(PPh3)3 comme catalyseur. Indiquez clairement sur votre schéma la structure des différents intermédiaires et la nature de chaque étape élémentaire. (6 points)