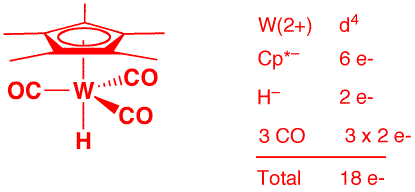
Nom : ...............................
Prénom : ..........................
Sart-Tilman, le 5 janvier 2009
En vous aidant du tableau périodique fourni, répondez de façon brève, claire et précise aux questions suivantes. Vos réponses doivent se trouver uniquement dans les espaces prévus à cet effet, sur les faces recto des feuilles, les faces verso peuvent être utilisées comme brouillons. Soignez les dessins des structures chimiques.
| Données: | dmpe = 1,2-bis(diméthylphosphino)éthane |
| dppe = 1,2-bis(diphénylphosphino)éthane |
Question 1. Proposez une structure plausible pour les complexes suivants. Représentez clairement sur votre schéma la géométrie autour du métal, les liaisons avec les ligands et les liaisons métal-métal éventuelles. Déterminez le nombre d'électrons périphériques des complexes en indiquant le détail de vos calculs. (10 points)
a) Cp*WH(CO)3 (2 points)
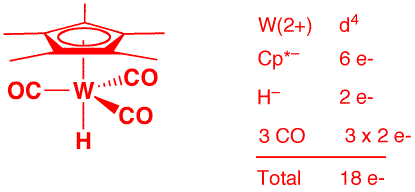
b) [Cp2Zr(η3-allyl)]+ (2 points)
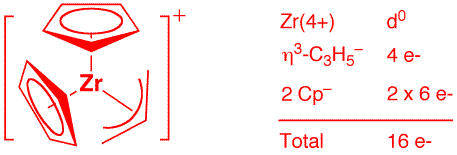
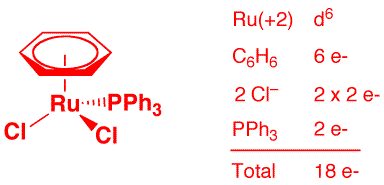
c) Mn(CO)(CN)(dppe)2 (2 points)
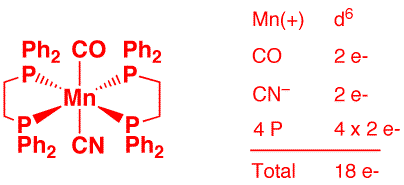
d) [Mn(CO)5]2 (2 points)
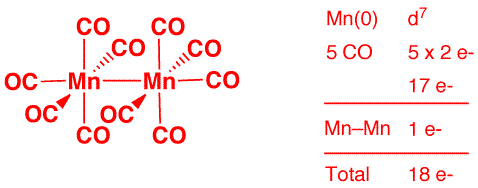
e) Ru(η6-C6H6)Cl2(PPh3) (2 points)
Question 2. Dans chacune des paires suivantes, encerclez le complexe qui devrait posséder la fréquence d'élongation νCO la plus élevée en spectroscopie infrarouge. Expliquez brièvement votre raisonnement pour chaque cas. (6 points)
a) [Co(CO)4]- -ou- [Fe(CO)4]2- (2 points)
[Co(CO)4]-
Co est plus électronégatif que Fe et est chargé une seule fois négativement
b) MnF(CO)5 -ou- WI2(CO)4 (2 points)
MnF(CO)5
Mn est plus électronégatif que W, possède un ligand CO supplémentaire et n'a qu'un seul autre ligand faiblement donneur F-
c) W(CO)2(dmpe)2 -ou- RuCl2(CO)2{P(OEt)3}2 (2 points)
RuCl2(CO)2{P(OEt)3}2
Dmpe est un meilleur donneur que P(OEt)3, W(0) est dans un état d'oxydation plus bas que Ru(+2) et W est moins électronégatif que Ru
Question 3. Dans chacune des paires suivantes, encerclez le complexe qui réagira le plus facilement par addition oxydante avec le substrat indiqué. Expliquez brièvement votre raisonnement pour chaque cas. (6 points)
a) CH4: CpRh(PMe3) -ou- HRe(CO)3(PMe3)2 (2 points)
CpRh(PMe3)
CH4 est un réactif très peu électrophile qui a absolument besoin d'une orbitale vacante sur un métal riche en électrons pour se précoordiner et être activé. Ce sera possible avec le complexe de rhodium qui a 16 e- et 2 bons donneurs mais pas avec le complexe de rhénium à 18 e-
b) HSiMe3: Hf(OMe)4 -ou- Cr(CH3)(OMe)3 (2 points)
Cr(CH3)(OMe)3
Le complexe de hafnium est d0 et ne peut plus être oxydé. Le complexe de chrome est d
c) H2: RhCl(PPh3)3 -ou- RhCl(CO)(PPh3)2 (2 points)
RhCl(PPh3)3
Les trois ligands phosphines rendent le rhodium de gauche plus riche en e- tandis que CO appauvrit celui de droite. (NB: la présence de trois phosphines volumineuses n'est pas un problème avec H2)
Question 4. Dans le complexe Ni(indényle)2 représenté ci-dessous, les distances entre le nickel et les cinq carbones les plus proches de chaque ligand ne sont pas équivalentes. Trois d'entre elles valent environ 2,0 Å tandis que les deux autres sont de l'ordre de 2,5 Å. Justifiez brièvement cette différence de longueur en vous basant sur l'hapticité du ligand. (2 points)
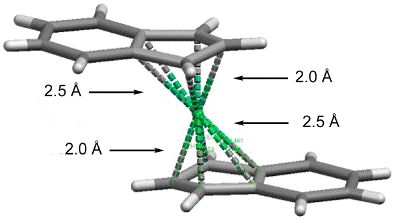
Ni(+2) d8
2 η3-indényle 2 x 4 e-
Total: 16 e-
Chaque ligand indényle est coordiné en mode η3-allylique et apporte 4 e- au métal. Au sein de chaque cyle à 5 chaînons, il y a donc 3 atomes de carbone liés au métal par des liaisons de 2,0 Å et 2 atomes non liés situés à une plus grande distance de 2,5 Å.
Question 5. Les résultats suivants ont été obtenus pour l'addition intramoléculaire d'un β-cétoester sur un alcyne terminal catalysée par des complexes d'or ou d'argent dans différentes conditions expérimentales (J. Am. Chem. Soc. 2004, 126, 4526-4527):

| Essai | Conditions expérimentales | Temps | Rendement |
| 1 | 10 mol% AgOTf, DCE, TA | 18 h | 50% |
| 2 | 10 mol% AgOTf, 10 mol% PPh3, DCE, TA | 18 h | 0% |
| 3 | 10 mol% AuCl3, DCE, TA | 30 min | 30% |
| 4 | 10 mol% Au(OTf)(PPh3), DCE, TA | 10 min | 95% |
| 5 | 1 mol% [{(Ph3P)Au}3O]BF4, 5 mol% HOTf, DCE, TA | 10 min | 98% |
a) Calculez le nombre maximum de turnovers pouvant être atteint au cours des essais 3 et 5. (2 points)
essai 3: 10 mol% de catalyseur -> TON = 10
essai 5: 1 mol% de catalyseur -> TON = 100
b) Calculez le nombre de turnovers réellement effectués par le catalyseur au cours des essais 3 et 5. (2 points)
essai 3: TON effectif = 10*(30/100) = 3
essai 5: TON effectif = 100*(98/100) = 98
c) Calculez en min-1 la fréquence effective des turnovers pour les essais 3 et 5. (2 points)
essai 3: TOF = 3/30 = 0,1 min-1
essai 5: TOF = 98/10 = 9,8 min-1
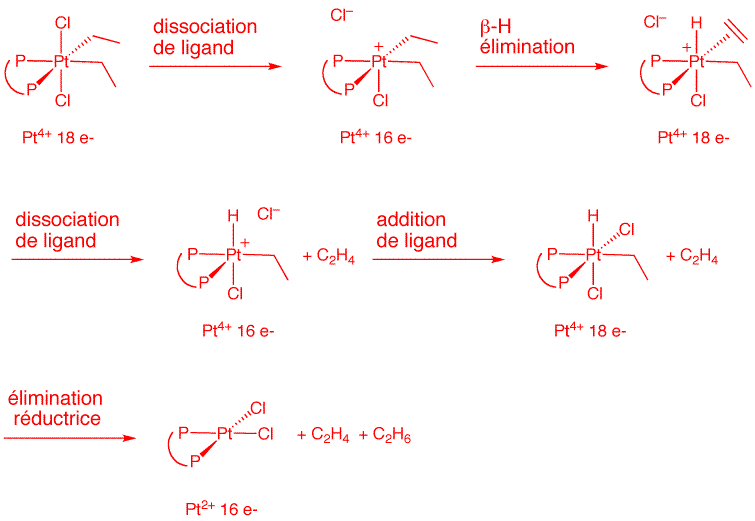
Question 6. Proposez un mécanisme plausible pour la réaction décrite ci-dessous. Dessinez clairement sur votre schéma la structure des différents intermédiaires en précisant pour chacun d'eux l'état d'oxydation du métal et son nombre d'électrons périphériques. Indiquez au dessus de chaque flèche réactionnelle le nom de l'étape élémentaire correspondante. (10 points)
PtCl2(CH2CH3)2(dmpe) ![]() PtCl2(dmpe) + H2C=CH2 + H3C-CH3
PtCl2(dmpe) + H2C=CH2 + H3C-CH3