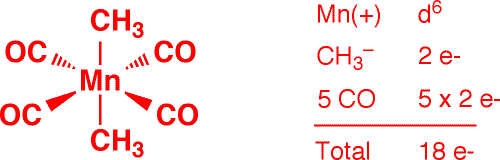
Nom : ...............................
Prénom : ..........................
Sart-Tilman, le 4 janvier 2010
En vous aidant du tableau périodique fourni, répondez de façon brève, claire et précise aux questions suivantes. Vos réponses doivent se trouver uniquement dans les espaces prévus à cet effet, sur les faces recto des feuilles, les faces verso peuvent être utilisées comme brouillons. Soignez les dessins des structures chimiques.
| Données: | dmpe = 1,2-bis(diméthylphosphino)éthane |
| dppe = 1,2-bis(diphénylphosphino)éthane |
Question 1. Proposez une structure plausible pour les complexes suivants. Représentez clairement sur votre schéma la géométrie autour du métal, les liaisons avec les ligands et les liaisons métal-métal éventuelles. Déterminez le nombre d'électrons périphériques des complexes en indiquant le détail de vos calculs. (5 points)
a) Mn(CO)5(CH3) (1 point)
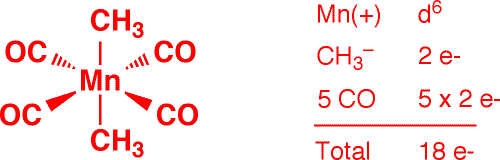
b) Ir2(μ-Br)2(CO)4 (1 point)
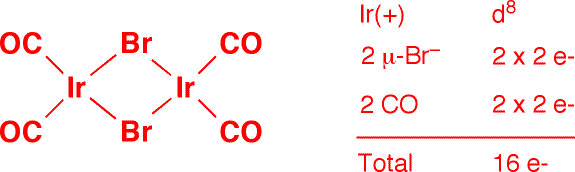
c) (trans-AuI2Ph2)- (1 point)
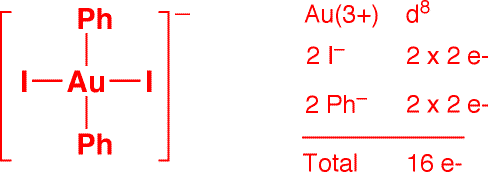
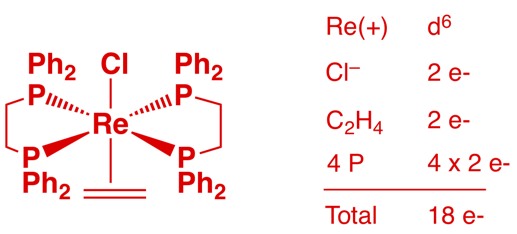
d) ReCl(H2C=CH2)(dppe)2 (1 point)
e) Co(η3-allyl)(CO)2(PMe3) (1 point)
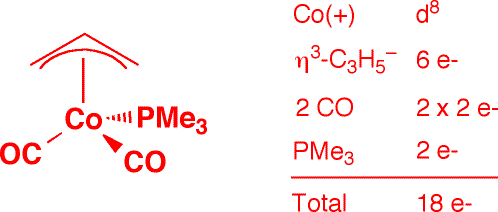
Question 2. Dans chacune des paires suivantes, encerclez le complexe qui devrait posséder la fréquence d'élongation νCO la plus basse en spectroscopie infrarouge. Expliquez brièvement votre raisonnement pour chaque cas. (3 points)
a) Cp*Mn(PMe3)(CO)2 -ou- CpIr(CO)2 (1 point)
Cp*Mn(PMe3)(CO)2
Le complexe de manganèse porte un ligand Cp* meilleur donneur que Cp. Il a aussi un ligand PMe3 très bon donneur -> meilleure rétrodonation
b) Re(dmpe)2(PMe3)(CO)]+ -ou- [Re(dppe)2(PPh3)(CO)]+ (1 point)
c) Cp2ScCl(CO) -ou- Cp2Hf(CO)2 (1 point)
Question 3. Expliquez brièvement le cycle catalytique suivant en indiquant pour chaque étape la nature des réactions chimiques élémentaires qui la composent et l'ordre dans lequel elles se déroulent. Pour étayer votre raisonnement, indiquez à proximité de chaque atome de rhodium son état d'oxydation et son nombre d'électrons de valence. (4 points)
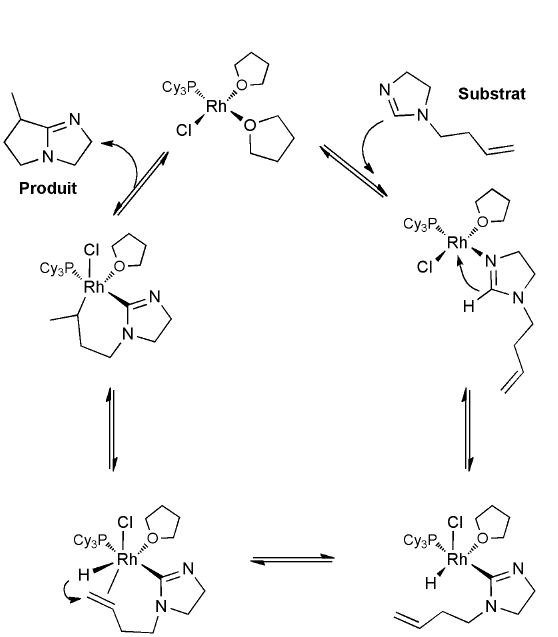
Question 4. La réaction catalytique décrite à la question 3 est effectuée à 160-180 °C en présence d'un excès de tricyclohexylphosphine, pourtant l'espèce active ne comporte vraisemblablement qu'un seul ligand PCy3 et pas deux. Justifiez cette hypothèse mécanistique. (2 points)
La tricyclohexylphosphine est un ligand très volumineux (θ = 170°) et très coordinant. Deux PCy3 rendraient le complexe stériquement trop encombré pour permettre la réaction. La présence d'un excès de PCy3 est destinée à compenser la température élevée requise pour la réaction, qui favorise la dissociation du ligand.
Question 5. Lorsqu'on effectue la réaction catalytique décrite à la question 3, une réaction secondaire conduit à la formation du produit d'isomérisation suivant:
Proposez un mécanisme plausible pour cette réaction secondaire en partant d'un des complexes représenté dans le cycle catalytique de la question 3. Indiquez clairement sur votre schéma la structure des différents intermédiaires et la nature de chaque étape élémentaire. (4 points)

Question 6. Le composé représenté ci-dessous pourrait-il être utilisé comme substrat pour la réaction catalytique de la question 3? Justifiez votre réponse. (2 points)
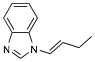
NON, à moins qu'il n'y ait une réaction d'isomérisation préalable car la cyclisation conduirait à un cycle à 4 pièces très tendu et requierrait une dépense énergétique trop importante (il faut déjà chauffer à 160-180 °C pour former un cycle à 5 chaînons).