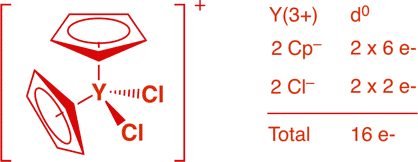
Nom : ...............................
Prénom : ..........................
Sart-Tilman, le 10 janvier 2011
En vous aidant du tableau périodique fourni, répondez de façon brève, claire et précise aux questions suivantes. Vos réponses doivent se trouver uniquement dans les espaces prévus à cet effet, sur les faces recto des feuilles, les faces verso peuvent être utilisées comme brouillons. Soignez les dessins des structures chimiques.
| Données: | dppe = 1,2-bis(diphénylphosphino)éthane |
| Naphos = 2,2'-bis(diphénylphosphanylméthyle)-1,1'-binaphtyle |
Question 1. Proposez une structure plausible pour les complexes suivants. Représentez clairement sur votre schéma la géométrie autour du métal, les liaisons avec les ligands et les liaisons métal-métal éventuelles. Déterminez le nombre d'électrons périphériques des complexes en indiquant le détail de vos calculs. (5 points)
a) [Cp2YCl2]- (1 point)
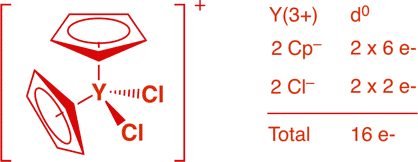
b) OsH2Cl2(PPh3)2 (1 point)

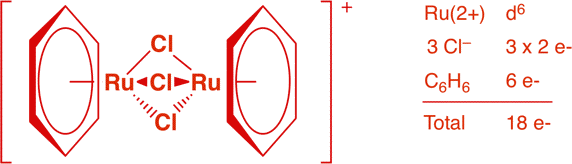
c) [Ru2(μ-Cl)3(η6-C6H6)2]+ (1 point)
d) W(CO)4(PMe3)2 (1 point)
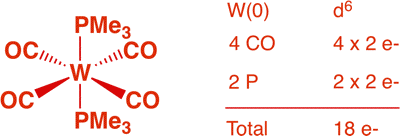
e) [(dppe)Pt(μ-H)(μ-CH2)Pt(dppe)]+ (1 point)
Question 2. Dans chacune des paires suivantes, encerclez le complexe qui réagira le plus facilement par addition oxydante avec le substrat indiqué. Expliquez brièvement votre raisonnement pour chaque cas. (3 points)
a) CH3I: RhCl(CO)3 -ou- IrH(CO)(PMe3)2 (1 point)
IrH(CO)(PMe3)2
Le complexe d'iridium sera plus facilement oxydé que celui de rhodium car il plus riche en électrons (moins de CO accepteurs et deux phosphines très bons donneurs)
b) H2: Cp2Nb(NMe)(CH3) -ou- [Rh(CO)2I2]- (1 point)
[Rh(CO)2I2]-
Le complexe de niobium est d0 -> oxydation impossible, celui de rhodium a une orbitale vacante -> OK pour H2
c) Cl2: Mo(CO)3(PMe3)3 -ou- [Mn(CO)3{P(OMe3}3]+ (1 point)
Mo(CO)3(PMe3)3
La phosphine est un bien meilleur donneur que le phosphite.
Question 3. Dans la liste ci-dessous, encerclez le classement correct des complexes dessinés par ordre de force de liaison M=CR2 décroissante. Justifiez votre réponse. (3 points)
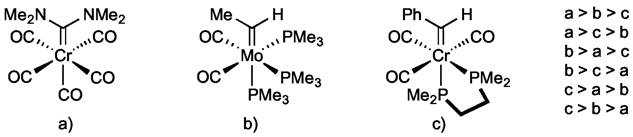
b > c > a
Le complexe b a la liaison métal-carbène la plus forte car il a les moins bons donneurs π sur son carbone carbénique, ce qui rend l'orbitale p vacante de ce carbone pleinement disponible pour accueillir une rétrodonation π du métal. L'atome de molybdène est aussi le plus riche en électrons car il possède 3 bons donneurs σ (les PMe3) et est moins électronégatif que le chrome. Le complexe c vient en second lieu car il a un phényle sur son fragment carbénique qui peut jouer le rôle de donneur π et entrer en compétition avec le métal pour la rétrodonation. Le complexe a est dernier car il a deux bons donneurs π sur le carbone carbénique et aucun sur le métal.
Question 4. Question 4. Les résultats suivants ont été obtenus pour l'hydroformylation des 1- et 2-pentènes avec le catalyseur HRh(CO)(Naphos):
Conditions expérimentales: alcène (70 mmol), HRh(CO)(Naphos) (7 μmol), 16 h de réaction à 120 °C sous pression de CO/H2.| Essai | Alcène | P (bar) | Rendement (%) | TON | TOF (h-1) |
|---|---|---|---|---|---|
| 1 | 1-pentène | 10 | 76 | ||
| 2 | 1-pentène | 50 | 88 | ||
| 3 | 2-pentène | 10 | 22 | ||
| 4 | 2-pentène | 50 | 7 |
a) Complétez le tableau ci-dessus en indiquant pour chaque essai le nombre de turnovers effectués par le catalyseur (TON) et la fréquence de turnover (TOF) exprimée en h-1. Indiquez brièvement votre raisonnement et le détail de vos calculs ci-dessous. (3 points)
Essai 1: TON = ((70.10-3/7.10-6)*76/100) = 7600, TOF = 7600/16 = 475 h-1
Essai 2: TON = ((70.10-3/7.10-6)*88/100) = 8800, TOF = 8800/16 = 550 h-1
Essai 3: TON = ((70.10-3/7.10-6)*22/100) = 2200, TOF = 2200/16 = 137,5 h-1
Essai 4: TON = ((70.10-3/7.10-6)*7/100) = 700, TOF = 700/16 = 43,75 h-1
b) A votre avis, pourquoi l'hydroformylation du 2-pentène donne-t-elle de moins bons résultats que celle du 1-pentène, en particulier quand la pression en CO/H2 est élevée? (2 points)
Le 1-pentène est un alcène terminal tandis que le 2-pentène est une oléfine interne. Ce dernier isomère présente un encombrement stérique plus important au niveau de la double liaison et sa coordination avec le métal sera plus difficile. La réaction sera donc plus lente, et ce d'autant plus que la pression en monoxyde de carbone est élevée, car ce gaz entre en compétition avec l'alcène pour jouer le rôle de ligand.
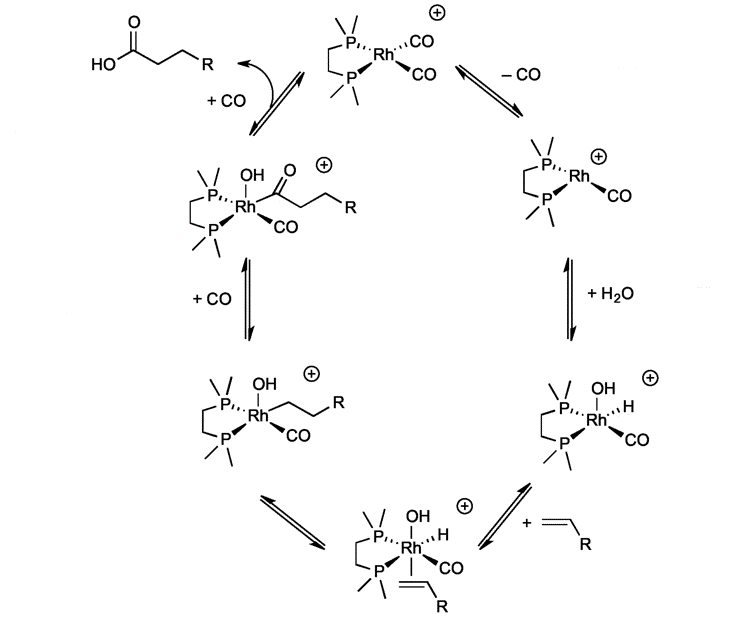
Question 5. Expliquez brièvement le cycle catalytique suivant en indiquant pour chaque étape la nature des réactions chimiques élémentaires qui la composent. Pour étayer votre raisonnement, indiquez à proximité de chaque atome de rhodium son état d'oxydation et son nombre d'électrons de valence. (4 points)