Nom : ...............................
Prénom : ..........................
Sart-Tilman, le 9 janvier 2012
En vous aidant du tableau périodique fourni, répondez de façon brève, claire et précise aux questions suivantes. Vos réponses doivent se trouver uniquement dans les espaces prévus à cet effet, sur les faces recto des feuilles, les faces verso peuvent être utilisées comme brouillons. Soignez les dessins des structures chimiques.
| Données: | py = pyridine, dmpe = 1,2-bis(diméthylphosphino)éthane |
Question 1. Proposez une structure plausible pour les complexes suivants. Représentez clairement sur votre schéma la géométrie autour du métal, les liaisons avec les ligands et les liaisons métal-métal éventuelles. Déterminez le nombre d'électrons périphériques des complexes en indiquant le détail de vos calculs. (5 points)
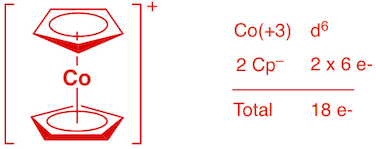
a) [Cp2Co]+ (1 point)

b) HPt(CH3)(PPh3)3 (1 point)
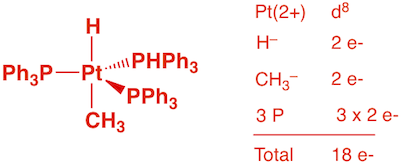
c) Ir4(CO)12 (1 point)
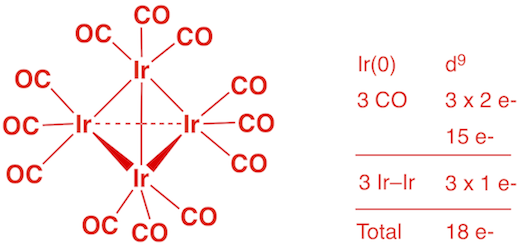
d) V(CO)6 (1 point)

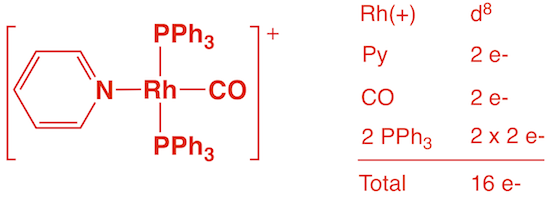
e) [trans-Rh(py)(CO)(PPh3)2]+ (1 point)
Question 2. Dans chacune des paires suivantes, encerclez le complexe qui perdra le plus facilement un ligand CO. Expliquez brièvement votre raisonnement pour chaque cas. (4 points)
a) HRh(CO)(PMe3)2 -ou- CoCl(CO){P(OMe)3}3 (1 point)
CoCl(CO){P(OMe)3}3
Le complexe de cobalt a trois ligands phosphites moins bons donneurs que les phosphines du complexe de rhodium
-> rétrodonation moins efficace vers le CO
-> dissociation plus aisée
b) Cp*2Hf(NBut)(CO) -ou- Cp2Zr(CO)2 (1 point)
Cp*2Hf(NBut)(CO)
Le complexe de hafnium est d0 et ne pourra pratiquement pas rétrocéder d'électrons au CO.
c) Rh2(μ-PMe2)2(CO)4 -ou- Ir2(μ-Cl)2(CO)4 (1 point)
Ir2(μ-Cl)2(CO)4
Le complexe d'iridium a des ponts μ-chloro moins bons donneurs d'électrons que les ponts μ-phosphidures.
d) [Ir(CO)2I2]- -ou- [Rh(CO)2Cl2]- (1 point)
[Rh(CO)2Cl2]-
Le complexe de rhodium a des ligands chloro moins bons donneur que les iodo et retient mieux ses électrons.
Question 3. Dans chacune des paires suivantes, encerclez le complexe qui devrait posséder le pKa le plus élevé. Expliquez brièvement votre raisonnement pour chaque cas. (4 points)
a) HRe(CO)3(PPh3)2 -ou- HRe(CO)3(dmpe) (1 point)
HRe(CO)3(dmpe)
Le ligand dmpe est un meilleur donneur que 2 PPh3, il rend l'hydrogène du rhénium plus hydrique et moins acide
-> pKa plus élevé
b) Cp2Ti(Br)(H) -ou- HCo(CO)4 (1 point)
Cp2Ti(Br)(H)
Le complexe de cobalt a quatre ligands CO très bons accepteurs π qui rendent son hydrogène fort acide tandis que le complexe de titane a des ligands cyclopentadiènyles donneurs d'électrons. Il sera donc moins acide et aura un pKa plus élevé.
c) [HRu(NCMe)(CO)4]+ -ou- HCo(CO)(PEt3)3 (1 point)
HCo(CO)(PEt3)3
Le complexe de ruthénium est cationique et n'a qu'un ligand acétonitrile donneur modéré pour quatre carbonyles très bons accepteurs π. Il sera donc fortement acide contrairement au complexe de cobalt porteur d'un seul carbonyle et de trois bons donneurs PEt3.
d) Cp*FeH(CO)2 -ou- CpCrH(CO)3 (1 point)
Cp*FeH(CO)2
Le complexe de chrome a 3 ligands CO accepteurs π et un donneur Cp- tandis que le complexe de fer n'a que 2 CO et un Cp* meilleur donneur que Cp. Le fer est donc plus riche en électrons et son hydrogène est moins acide -> pKa le plus élevé.
Question 4. Selon vous, laquelle des deux réactions représentées ci-dessous est la plus rapide? Justifiez brièvement votre réponse. (2 points)
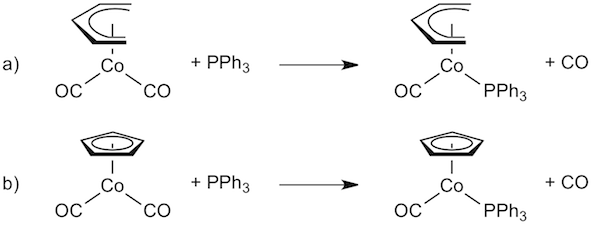
Les deux complexes sont saturés et doivent d'abord libérer une vacance pour que l'échange de ligand puisse avoir lieu. Ce sera plus facile à réaliser pour le complexe porteur du ligand pentadiènyle non cyclique et non-aromatique qui passe aisément de la coordination η5 (donneur de 6 e-) à η3 (donneur de 4 e-) que pour le ligand cyclopentadiènyle aromatique.
-> la réaction a) est la plus rapide
Question 5. Décomposez la réaction représentée ci-dessous en six étapes élémentaires successives. Précisez la nature de chaque étape et donnez son équation complète et équilibrée. Pour étayer votre raisonnement, indiquez à proximité de chaque atome métallique son état d'oxydation et son nombre d'électrons de valence. La réponse attendue pour la sixième étape vous est donnée à titre d'exemple. (5 points)
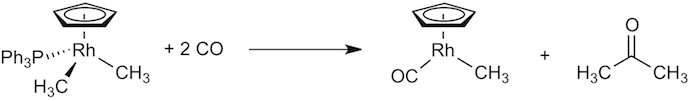
a) étape 1 (1 point):

a) étape 2 (1 point):

a) étape 3 (1 point):
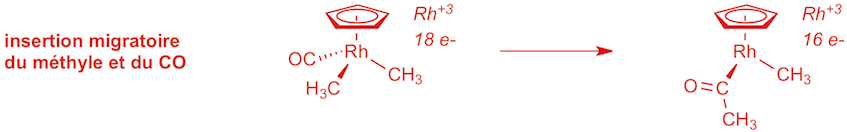
a) étape 4 (1 point):
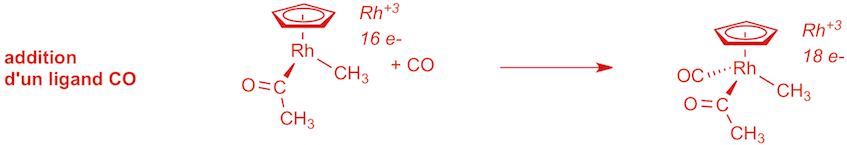
a) étape 5 (1 point):
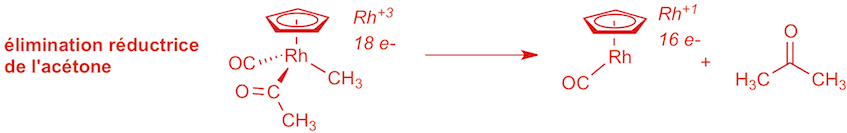
a) étape 6 (1 point):
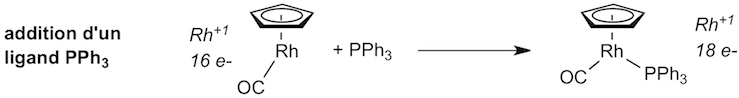
Question 6. En appliquant la théorie des orbitales frontières, déterminez la nature des produits A et B obtenus au cours des réactions décrites ci-dessous. Veillez à indiquer clairement de quel type de réaction il s'agit et la stéréochimie des produits obtenus. (4 points)
a) (2 points) 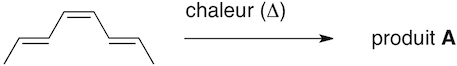

b) (2 points) 

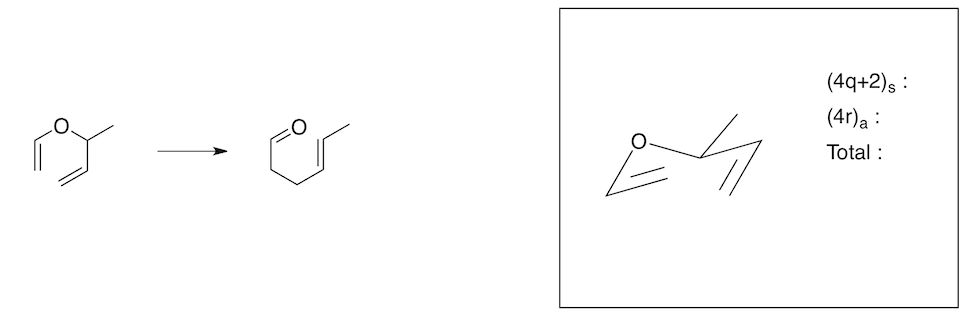
Question 7. Complétez les schémas ci-dessous en appliquant les règles généralisées de symétrie orbitalaire et montrez que les réactions décrites sont permises thermiquement. (4 points)
a) (2 points)
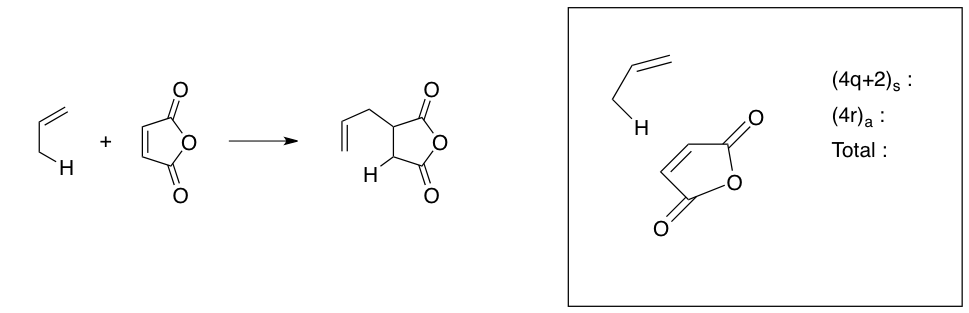
b) (2 points)
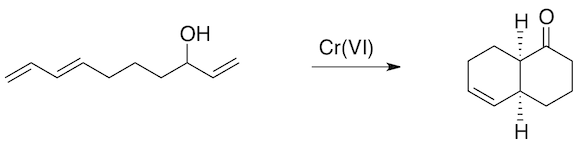
Question 8. L'alcool insaturé représenté ci-dessous est parfaitement stable et peut être isolé, tandis que son produit d'oxydation avec le chrome(VI) se cyclise instantanément. Expliquez brièvement cette différence de comportement. (2 points)
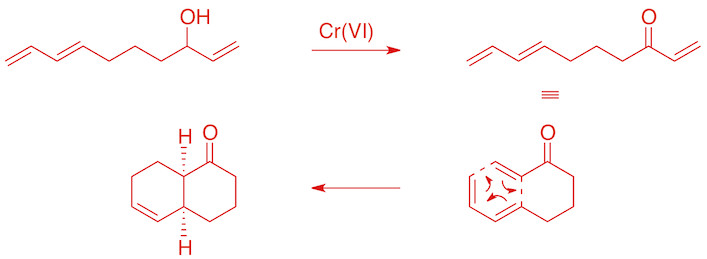
L'oxydation de l'alcool allylique en cétone α,β-insaturée rend le diènophile plus pauvre en électrons -> la réaction avec le diène se produit instantanément.
Question 9. Proposez un mécanisme réactionnel plausible ne faisant intervenir que des étapes concertées pour expliquer la transformation suivante. Indiquez clairement sur votre schéma réactionnel les liaisons en cours de formation et le mouvement des électrons. Précisez le type de réaction péricyclique effectuée pour chaque étape. (5 points)
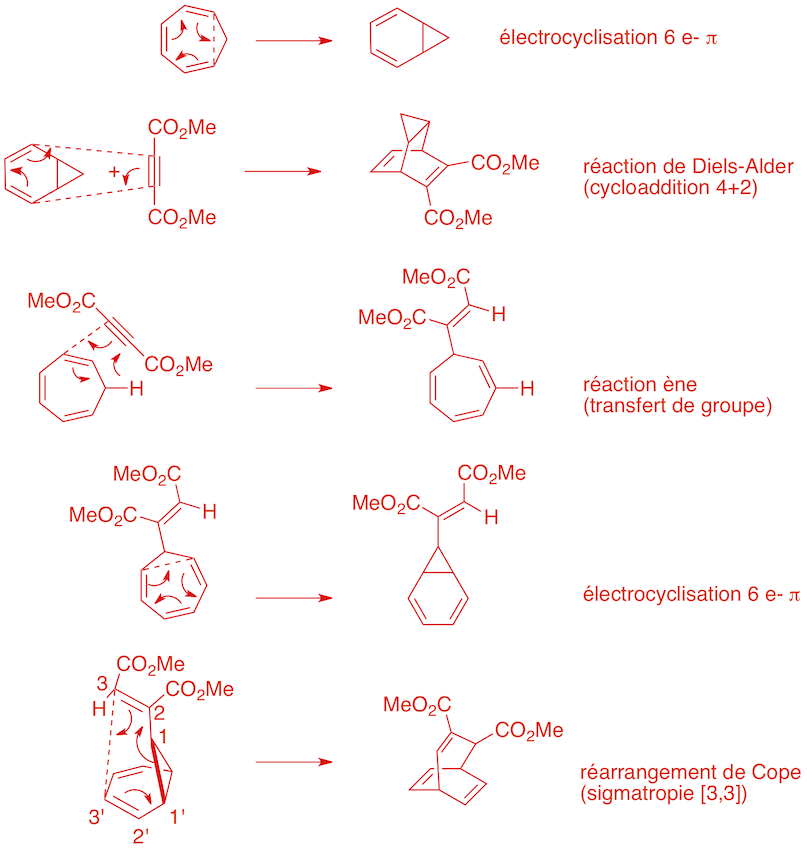
Question 10. Proposez une structure pour le produit de la réaction de Diels-Alder représentée ci-dessous. Justifiez votre choix en termes de régio- et de stéréosélectivité. (5 points)
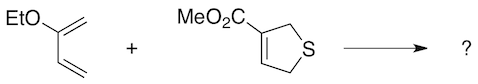
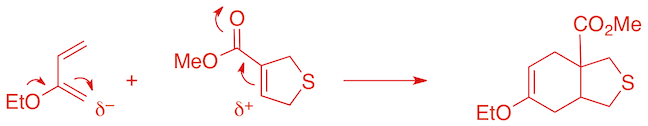
Régiosélectivité: seul l'isomère avec les groupes éthoxy et carbométhoxy en "para" l'un de l'autre est obtenu, ce choix peut se justifier sur base de considérations électrostatiques.

Stéréosélectivité: l'ester et l'hydrogène en tête de pont sont en cis dans le diènophile et restent en cis dans le produit, ceci est dû à la nature de l'état de transition.