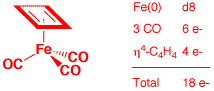
En vous aidant du tableau périodique fourni, répondez de façon brève, claire et précise aux questions suivantes. Vos réponses doivent se trouver uniquement dans les espaces prévus à cet effet, sur les faces recto des feuilles, les faces verso peuvent être utilisées comme brouillons. Soignez les dessins des structures chimiques.
Question 1. Proposez une structure plausible pour les complexes suivants. Représentez clairement sur votre schéma la géométrie autour du métal et les liaisons avec les ligands. Déterminez le nombre d'électrons périphériques des complexes en indiquant le détail de vos calculs. (10 points)
a) Fe(η4-C4H4)(CO)3 (2 points)
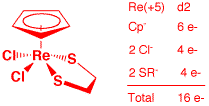
b) CpReCl2(η2-SCH2CH2S) (2 points)
c) IrH2Cl(CO)(PPh3)3 (2 points)
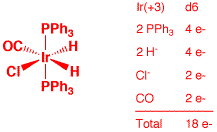
d) [CpFe(C6H6)]+ (2 points)
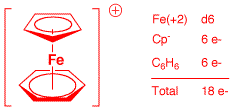
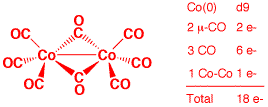
e) Co2(μ-CO)2(CO)6 (2 points)
Question 2. Dans chacune des paires suivantes, encerclez le complexe qui devrait posséder la fréquence d'élongation νCO la plus élevée en spectroscopie infrarouge. Expliquez brièvement votre raisonnement pour chaque cas. (10 points)
a) [Rh(CO)4]- ou [Fe(CO)4]2- (2 points)
[Rh(CO)4]-
Le fer et le rhodium ont des électronégativités similaires et le même nombre de ligands CO mais Fe est dans l'état d'oxydation -2 tandis que Rh est dans l'état d'oxydation -1. Le rhodium est donc moins riche en électrons que le fer et ne peut pas rétrocéder aussi facilement ses électrons d dans l'orbitale π* des CO. Il conduira donc à la fréquence d'élongation νCO la plus élevée.
b) [Re(PMe3)(N![]() CMe)(CO)4]+ ou Cp2La(NMe)2(CO) (2 points)
CMe)(CO)4]+ ou Cp2La(NMe)2(CO) (2 points)
Cp2La(NMe)2(CO)
Le complexe de La est d0 et ne peut pas donner lieu à une rétrodonation significative vers l'orbitale π* du CO qui lui est lié.
c) Cp*OsBr(CO)2 ou CpFeF(CO)2 (2 points)
CpFeF(CO)2
Cp- et F- sont respectivement de moins bons donneurs que Cp* et Br-. En outre, le fer est plus électronégatif que l'osmium. La rétrodonation d'électrons d vers les orbitales π* des CO sera donc moins bonne dans le second complexe.
d) Ni(PPh3)(CO)3 ou CpIr(CO)2 (2 points)
Ni(PPh3)(CO)3
Cp- est un meilleur donneur que PPh3, le complexe d'iridium n'a que 2 ligands CO en compétition pour la rétrodonation tandis que le complexe de nickel en a 3 et Ir est moins électronégatif que Ni. Le complexe d'iridium sera donc le plus riche en électrons et aura la fréquence de vibration la plus basse.
e) [Re(PMe3)2(CO)4]+ ou [Mn{P(OPh)3}2(CO)4]+ (2 points)
[Mn{P(OPh)3}2(CO)4]+
Les deux complexes sont cationiques et ont le même nombre de ligands CO mais les triarylphosphites sont de moins bons donneurs et de meilleurs π-accepteurs que les trialkylphosphines. De plus, Mn est plus électronégatif que Re et retiendra davantage ses électrons. La rétrodonation sera donc moins bonne et la fréquence νCO plus élevée.
Question 3. Indiquez pour chacune des réactions suivantes les étapes élémentaires qui la composent et l'ordre dans lequel ces étapes se déroulent. (10 points)
a) CpIrCl(η3-allyl) + PMe3 ![]() CpIrCl(PMe3)(η1-allyle) (2 points)
CpIrCl(PMe3)(η1-allyle) (2 points)
1. Changement de coordination du ligand allyle (de η3 vers η1)
2. Addition du ligand PMe3
b) CpRh(CO)2 + CF3CF2Br ![]() CpRh(CO)(CF2CF3)Br + CO (2 points)
CpRh(CO)(CF2CF3)Br + CO (2 points)
1. Addition oxydante de CF3CF2Br avec départ de Br-
2. Dissociation du ligand CO
3. Addition du ligand Br-
c) H2RhCl(PPh3)2(CH2CH3) ![]() HRhCl(PPh3)2 + CH3CH3 (2 points)
HRhCl(PPh3)2 + CH3CH3 (2 points)
1. Elimination réductrice de H et CH2CH3
ou
1. Dissociation du ligand PPh3 (pour former un complexe à 16 e- à partir duquel l'élimination
réductrice est plus aisée)
2. Elimination réductrice de H et CH2CH3
3. Addition du ligand PPh3
d) CpFe(CO)2(CH3) + PPh3 ![]() CpFe(CO)(COCH3)(PPh3) (2 points)
CpFe(CO)(COCH3)(PPh3) (2 points)
1. Insertion migratoire des ligands CO et CH3 pour former COCH3
2. Addition du ligand PPh3
e) PtCl2(CH2CH3)2(PMe3)2 ![]() PtCl2(PMe3)2 + CH2=CH2 + CH3CH3 (2 points)
PtCl2(PMe3)2 + CH2=CH2 + CH3CH3 (2 points)
1. Dissociation d'un ligand Cl-
2. Elimination d'un b-hydrure pour former HPtCl(CH2CH3)(CH2=CH2)(PMe3)2
3. Dissociation du ligand CH2=CH2
4. Elimination réductive de H et CH2CH3
5. Addition du ligand Cl-
Question 4. Dans chacune des paires suivantes, encerclez le complexe qui réagira le plus facilement par addition oxydante avec le substrat indiqué. Expliquez brièvement votre raisonnement pour chaque cas. (10 points)
a) H2: RhCl(CO)(PPh3)2 ou RhI(CO)(PPh3)2 (2 points)
RhI(CO)(PPh3)2
L'iodure est un meilleur donneur que le chlorure et rendra le rhodium plus riche en électrons. Sa plus grande taille n'est pas gênante vis-à-vis de la petite molécule d'hydrogène.
b) CH3Br: [Mn(CO)5]- ou [V(NR)2(CH3)2(PMe3)]- (2 points)
[Mn(CO)5]-
Le vanadium du second complexe a une structure d0 et ne peut pas faire d'addition oxydante.
c) SiH4: Cp2Re(CH3) ou (η5-indényle)RuCl(dppe) (2 points)
(η5-indényle)RuCl(dppe)
Le ligand indényle peut passer aisément d'une coordination η5 à η3 libérant ainsi une orbitale vacante pour la coordination de SiH4.
d) Br2: [Cr(CH3)(N![]() CMe)(dppe)2]+ ou W(CH3)6 (2 points)
CMe)(dppe)2]+ ou W(CH3)6 (2 points)
[Cr(CH3)(N![]() CMe)(dppe)2]+
CMe)(dppe)2]+
Le tungstène du second complexe a une structure d0 et ne peut pas faire d'addition
oxydante.
e) H2: Fe(PMe3)2(CO)3 ou MnCl(dmpe)2 (2 points)
MnCl(dmpe)2
Le complexe de fer possède 18 e- et des ligands fortement coordinants tandis que le complexe de manganèse n'a que 16 e- et un ligand chlorure.
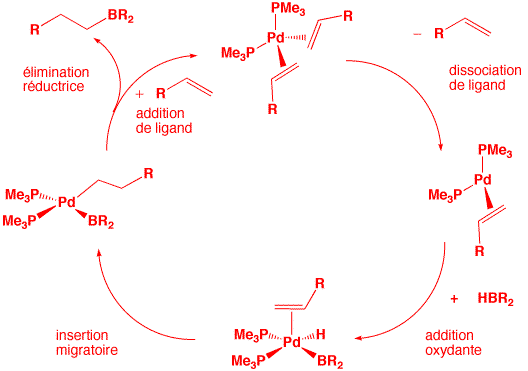
Question 5. Proposez un cycle catalytique pour effectuer la réaction d'hydroboration suivante en utilisant comme catalyseur le complexe Pd(PMe3)(RCH=CH2)2.
![]()